
【题目】中学化学中下列各物质间不能实现 (“→”表示一步完成)转化的是
(“→”表示一步完成)转化的是
选项 | A | B | C | D |
a | CH3CH2OH | CH2=CH2 | Cl2 | C |
b | CH3CHO | CH3CH2Br | HClO | CO |
c | CH3COOH | CH3CH2OH | HCl | CO2 |
A. AB. BC. CD. D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、X、W、D、E为短周期元素,且原子序数依次增大。A、D同主族,X、W同周期, X形成的气态氢化物可使湿润的红色石蕊试纸变蓝, A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等。
(1)W的原子结构示意图为________。
(2)A、W两种元素能形成含18电子的分子,请写出该分子的电子式:_______________。用电子式表示化合物D2W的形成过程______________________。
(3)下列事实能说明W元素的非金属性比S元素的非金属性强的是________ (填字母)。
a.W单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol W单质比1 mol S得电子多
c.W和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X的最高价氧化物对应水化物与其简单气态氢化物所形成的化合物中含有的化学键类型是_______
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用A2W2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100mL 4.40 mol/L盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28g。过滤,滤液中无Cu2+。将滤液加水稀释到200mL,测得其中c(H+)为0.400mol/L。则原混合物中单质铁的质量是 ( )
A. 2.24g B. 3.36g C. 5.60g D. 10.08g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于图中装置说法正确的是

A. 装置中电流移动的途径:正极→Fe→M溶液→石墨→正极
B. 若M为滴加酚酞的NaCl溶液,通电一段时间后,铁电极附近溶液显红色
C. 若M为CuSO4溶液,可以实现石墨上镀铜
D. 若将电源反接,M为NaCl溶液,可以用于制备Fe(OH)2并可以使其较长时间保持白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的说法不正确的是 ( )
A. 化石能源物质内部贮存着大量的能量
B. 植物的光合作用使太阳能转化为化学能
C. 燃料燃烧时只是将化学能转化为热能
D.由石墨制金刚石是吸热反应,故石墨能量比金刚石能量低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c、d、e为元素周期表中前4周期的一部分元素,下列有关叙述正确的是( )
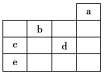
A. 元素b位于第ⅥA族,有+6、-2价两种常见化合价
B. 五种元素中,元素e的性质最稳定
C. 元素c和d的最高价氧化物对应的水化物的酸性:c>d
D. 元素c和e的气态氢化物的稳定性:c>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几组物质,请将序号填入下列空格内:
A、CH2=CH﹣COOH和油酸(C17H33COOH)
B、12C60和石墨
C、![]() 和
和![]()
D、35Cl和37Cl
E、乙醇和乙二醇
(1)互为同位素的是 ;
(2)互为同系物的是 ;
(3)互为同素异形体的是 ;
(4)互为同分异构体的是 ;
(5)既不是同系物,又不是同分异体,也不是同素异形体,但可看成是同一类物质的是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨的合成对国家工业发展有着举足轻重的作用,请根据化学原理知识回答下列问题:
(1)已知氢气的燃烧热为285.8kJ/mol。
4NH3 (g) +5O2 (g) ![]() 4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
4NO(g) + 6H2O(l) △H= —1168.8kJ/mol
N2(g)+ O2(g)═ 2NO(g)△H = +180.6kJ/mol。
则工业合成氨的热化学方程式为________________。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。实验结果如图所示:(图中 T表示温度, n表示物质的量)

①图像中 T2和 T1的关系是: T2 _______________ T1(填“高于”、“低于”、 “等于”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N 2 的转化率最高的是_______________(填字母)。
③在起始体系中n(N2):n(H2)= 1:3时,反应后氨的百分含量最大;若容器容积为1L, n=3mol反应达到平衡时H2的转化率为60%,则此条件下( T 2),反应的平衡常数 K=__________________。
(3)氮元素的+4价氧化物有两种,它们之间发生反应:2NO2![]() N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________
N2O4 H < 0,将一定量的NO2充入注射器中后封口,下图是在拉伸和压缩注射器的过程中气体透光率随时间的变化 (气体颜色越深,透光率越小)。下列说法正确的是______________

A.b点的操作是压缩注射器
B.c点与a点相比, c(NO2)增大, c(N2O4)减小
C.若不忽略体系温度变化,且没有能量损失,则b、c两点的平衡常数Kb>Kc
D.d点:v(正)> v(逆)
(4)利用反应6NO2+8NH3=7N2+12H2O构成原电池,能消除氮氧化物的排放,减轻环境污染,装置如图所示。

①电极a为___________________极,其电极反应式为__________________。
②当有0.1 mol NO2被处理时,转移电子为________________mol。
③为使电池持续放电,该离子交换膜需选用___________________交换膜。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com