
【题目】A、B、C、D、E、F是原子序数依次递增的前四周期元素。A是宇宙中含量最丰富的元素;D与E同主族,且E的原子序数是D的两倍;B与D组成的化合物是一种温室气体;C元素原子最外层P能级比S能级多1个电子;F原子的最外层电子数与A相同,其余各层均充满。据此回答下列问题。
(1)F元素形成的高价基态离子的核外电子排布式为__________。
(2)E的一种具有强还原性的氧化物分子的VSEPR模型为__________。
(3)C、D、E元素的第一电离能由大到小的顺序是__________。(用元素符号表示)
(4)A和D形成的18电子化合物难溶于BE2,其理由是__________,此化合物还可将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为__________
(5)C有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L甲气体与0.5L氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的含氧酸盐的化学式是__________。
(6)F与C形成化合物的晶胞如图所示,该化合物的化学式为_____________,C离子的配位数是_____________。
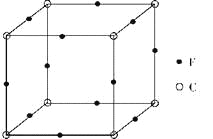
【答案】1s22s22p63s23p63d9 平面三角形 N>O>S H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2 H2O2+CN-+OH-=CO32-+NH3 NaNO2 Cu3N 6
【解析】
A、B、C、D、E、F是原子序数依次递增的前四周期元素,A是宇宙中含量最丰富的元素,所以A是H元素;D与E同主族,且E的原子序数是D的两倍,所以D为O,E为S;B与D组成的化合物是一种温室气体,温室气体是CO2,则B为C;C元素原子最外层P能级比S能级多1个电子,则C为N;F原子的最外层电子数与A相同,其余各层均充满,则F为Cu。
(1)F为Cu,Cu2+的核外电子排布式为1s22s22p63s23p63d9;
(2)E为S,其具有强还原性的氧化物分子是SO2,VSEPR理论:价层电子对=3,成键电子对=2,孤电子对=1,基本构型为三角形,其中孤电子对占据一个顶点,分子构型为V形;
(3)同周期元素,第一电离能从左到右逐渐增大,但N原子的P轨道处于半充满状态,比相邻元素的第一电离能都大,同主族的第一电离能从上到下逐渐减小,所以S、N、O第一电离能由大到小的顺序是N>O>S;
(4)H2O2难溶于CS2的理由是H2O2为极性分子,而CS2为非极性溶剂,根据“相似相溶”规律,H2O2难溶于CS2,H2O2能将碱性工业废水中的CN-氧化为碳酸盐和氨,相应的离子方程式为H2O2+CN-+OH-=CO32-+NH3;
(5)在N的氧化物中,NO的相对分子质量最小,体积和物质的量成正比,NO和氧气4:1反应生成NO2,根据2NO+O2=2NO2所以得到等物质的量的NO2和NO的混合物,根据NO2+NO+2NaOH=2NaNO2+H2O,所生成的含氧酸盐的化学式是NaNO2;
(6)该晶胞中Cu原子的个数为12×1/4=3,N原子的个数为8×1/8=1,该化合物的化学式为Cu3N,N离子位于晶胞的顶点,Cu位于晶胞的棱上,所以N离子的配位数是8×3×1/4=6。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某无色溶液中只可能溶有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等离子中的几种离子。为分析其组成,现进行如下实验:
等离子中的几种离子。为分析其组成,现进行如下实验:
![]() 取10mL该溶液于试管中滴加足量的
取10mL该溶液于试管中滴加足量的![]() 溶液,加稀硝酸酸化后过滤得到
溶液,加稀硝酸酸化后过滤得到![]() 白色沉淀甲.
白色沉淀甲.
![]() 取上述反应后的滤液,加入
取上述反应后的滤液,加入![]() 溶液未见沉淀产生.
溶液未见沉淀产生.
![]() 另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为
另取10mL该溶液于试管中,滴加NaOH溶液产生白色沉淀乙,当加入NaOH的物质的量为![]() 时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为
时,沉淀的量达到最大;继续滴加NaOH溶液并加热,开始产生气体丙,收集气体丙,体积换算成标况下为![]() 假设丙全部逸出
假设丙全部逸出![]() ,最后沉淀完全溶解。
,最后沉淀完全溶解。
下列推断正确的是![]()
A.肯定有![]() 、
、![]() 、
、![]() 、
、![]()
B.肯定有![]() 、
、![]() 、
、![]()
C.肯定没有![]() 、
、![]() 、
、![]()
D.肯定没有![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:
Ⅰ.二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化.有关甲醛、苯、二氧化碳及水说法正确的是__。
A.苯与B3N3H6互为等电子体
B.甲醛、苯分子中碳原子均采用sp2杂化
C.苯、二氧化碳是非极性分子,水和甲醛是极性分子
D.水的沸点比甲醛高得多,是因为水分子间能形成氢键
Ⅱ.2007年诺贝尔物理学奖为法国科学家阿尔贝费尔和德国科学家彼得格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如图1),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
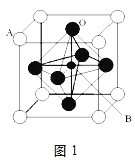
(1)用A、B、O表示这类特殊晶体的化学式:__。
(2)已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3,(x<0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:__(用含x的代数式表示)。
(3)Mn的核外电子排布式为:___。
(4)下列有关说法正确的是___。
A.镧、锰、氧分别位于周期表f、d、p区
B.氧的第一电离能比氮的第一电离能大
C.锰的电负性为1.59,Cr的电负性为1.66,说明锰的金属性比铬强
D.铬的堆积方式与钾相同,则其堆积方式如图2:
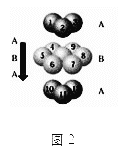
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M是表面分子、药物的中间体,N是一种高分子化合物。实验室由A、B两种烃制备M和N一种合成路线如下: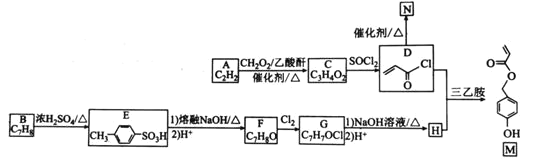
已知:![]()
回答下列问题:
(1)B的化学名称为________。N的结构简式为_____________________。
(2)由A生成C的反应类型为____。G中官能团的名称为______________。
(3)由F转化为G的条件为________________________________。
(4)由D和H生成M的化学方程式为_________________________。
(5)![]() 是M的同分异构体,同时满足下列条件的X的结构有_________种。
是M的同分异构体,同时满足下列条件的X的结构有_________种。
①能与![]() 溶液发生显色反应
溶液发生显色反应
②能发生银镜反应,且![]() 最多生成
最多生成![]()
③核磁共振氢谱中有5组吸收峰
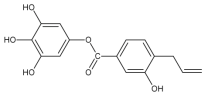
(6)参照上述合成路线和信息,设计以苯和甲醛为原料制备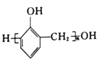 的合成路线
的合成路线![]() 无机试剂任选
无机试剂任选![]() :________________________________。
:________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,冰醋酸加水稀释的过程中,溶液导电能力(I)随加水的体积(V)变化如图所示,下列说法正确的是( )
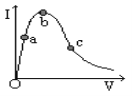
A.“O”点导电能力为0的理由是冰醋酸是固体,内部的离子不能自由移动
B.a、b、c三点中,a点c(H+)最大,因为电解质溶液浓度越大,离子浓度就越大
C.a、b、c三点中,a点水电离的程度最小
D.加大量水稀释,溶液中所有微粒浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于该物质,下列说法正确的是()
A.1mol该物质最多与8mol H2发生加成反应
B.1mol该物质最多与5mol Br2反应
C.1mol该物质最多与6mol NaOH发生反应
D.可以用酸性高锰酸钾溶液检验该物质中含有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锅炉水垢既会降低燃料的利用率、影响锅炉的使用寿命,还可能造成安全隐患.
![]() 某锅炉水垢的主要成分有
某锅炉水垢的主要成分有![]() 、
、![]() 、
、![]() 、
、![]() ,用酸洗法可除去该水垢,其基本原理如图1所示.
,用酸洗法可除去该水垢,其基本原理如图1所示.
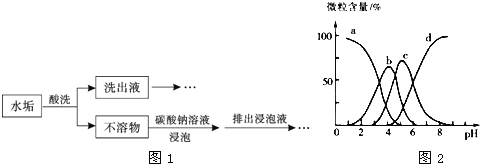
![]() 酸洗时,为使水垢尽可能溶解,不宜选用的是 ______
酸洗时,为使水垢尽可能溶解,不宜选用的是 ______ ![]() 填标号
填标号![]() .
.
A.稀硫酸![]() 盐酸
盐酸![]() 硝酸
硝酸![]() 醋酸
醋酸
![]() 不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 ______ .
不溶物用碳酸钠溶液浸泡时,反应的离子方程式是 ______ .
![]() 洗出液中的
洗出液中的![]() 会腐蚀铁质管道,反应的离子方程式是 ______ ,因此,常在洗出液中加入具有强还原性的
会腐蚀铁质管道,反应的离子方程式是 ______ ,因此,常在洗出液中加入具有强还原性的![]() 溶液,反应中的
溶液,反应中的![]() 与
与![]() 的物质的量之比为1:2,
的物质的量之比为1:2,![]() 转化为
转化为![]() ______
______ ![]() 填离子符号
填离子符号![]() .
.
![]() 柠檬酸
柠檬酸![]() 用
用![]() 表示
表示![]() 可用作酸洗剂,溶液中
可用作酸洗剂,溶液中![]() 、
、![]() 、
、![]() 、
、![]() 的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 ______
的含量与pH的关系如图2所示.图中a曲线所代表的微粒的百分含量随溶液pH的改变而变化的原因是 ______ ![]() 调节柠檬酸溶液的
调节柠檬酸溶液的![]() ,有利于除去水垢中的氧化铁.
,有利于除去水垢中的氧化铁.![]() 时,溶液中上述4种微粒含量最多的是 ______ .
时,溶液中上述4种微粒含量最多的是 ______ .
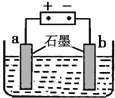
![]() 利用下图所示装置对锅炉水
利用下图所示装置对锅炉水![]() 含
含![]() 、
、![]() 、
、![]() 进行预处理,可有效防止锅炉水垢的形成.电解过程中,
进行预处理,可有效防止锅炉水垢的形成.电解过程中,![]() 、
、![]() 在 ______
在 ______ ![]() 填“a”或“b”
填“a”或“b”![]() 极附近形成沉淀.
极附近形成沉淀.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知最简单的有机物E和直线型分子G在光照条件下反应,生成四面体型分子L和直线型分子M(组成G分子的元素为第三周期的元素),如下图。则下列判断错误的是
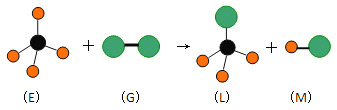
A. 常温常压下,E是一种无色无味的气体
B. 上述反应类型是加成反应
C. 在光照条件L能与 G继续发生与上述类似的反应
D. 上述反应类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种形状像蝴蝶结的有机分子Bowtiediene,其形状和结构如图所示,下列有关该分子的说法中错误的是

A.1 mol 该物质彻底燃烧需要6 mol O2
B.三氯代物只有一种
C.该分子中所有碳原子在同一平面内
D.与其互为同分异构体,且官能团只含碳碳三键的链烃有两种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com