
| A | 完全燃烧的产物中n(CO2):n(H2O)=2:1 28<Mr(A)<60 不能使溴的四氯化碳溶液褪色 一氯代物只有1种结构 |
| B | 饱和链烃,通常情况下呈气态 二溴代物有3种 |
 ;
;分析 A完全燃烧的产物中n(CO2):n(H2O)=2:1,故A的组成可以表示为(CH)n,由于28<M(A)<60,故28<13n<60,解得2.2<n<4.7,不能使溴的四氯化碳溶液褪色,说明分子中不含不饱和键,一氯代物只有一种结构,说明分子中H原子为等效H原子,不能使溴的四氯化碳溶液褪色,故碳碳之间都是单键,故n=4,为正四面体结构,A为 ;
;
B是饱和链烃,通常情况下呈气态,碳原子数目小于5(新戊烷除外),有同分异构体,碳原子数目大于3,二溴代物有三种为,故B为CH(CH3)3,据此解答.
解答 解:A完全燃烧的产物中n(CO2):n(H2O)=2:1,故A的组成可以表示为(CH)n,由于28<M(A)<60,故28<13n<60,解得2.2<n<4.7,不能使溴的四氯化碳溶液褪色,说明分子中不含不饱和键,一氯代物只有一种结构,说明分子中H原子为等效H原子,碳碳之间都是单键,故n=4,A分子式为C4H4,为正四面体结构,A为 ;
;
B是饱和链烃,通常情况下呈气态,碳原子数目小于5(新戊烷除外),有同分异构体,碳原子数目大于3,二溴代物有三种为,故B为CH(CH3)3,
(1)A分子式为C4H4,最简式是CH,故答案为:CH;
(2)由上述分析可知,烃A的结构简式是 ,故答案为:
,故答案为: ;
;
(3)B为CH(CH3)3,三种二溴代物的结构简式为:CHBr2CH(CH3)2、CH2BrCBr(CH3)2、CH2BrCH(CH3)CH2Br,
故答案为:CHBr2CH(CH3)2、CH2BrCBr(CH3)2、CH2BrCH(CH3)CH2Br.
点评 本题考查有机推断,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,推断A的结构是本题的难点、易错点,难度中等.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| R | 基态原子的最外层有3个未成对电子,次外层有2个电子 |
| S | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| T | 基态原子3d轨道上有1个电子 |
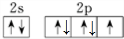
| X |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+Cl2(g)=2HCl(g)△H=-184.6kJ/mol | |
| B. | CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-802.3kJ/mol | |
| C. | 2C8H18(g)+25O2(g)=16CO2(g)+18H2O(l)△H=-5518kJ/mol | |
| D. | CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第14列元素中未成对电子数是同周期元素中最多的 | |
| B. | 只有第2列的元素原子最外层电子排布为ns2 | |
| C. | 第四周期第8列元素是铁元素 | |
| D. | 第15列元素原子的价电子排布为ns2np5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
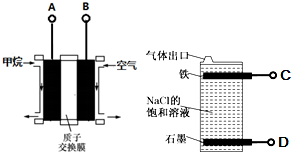
| A. | 燃料电池的A极连接电解池的C极 | |
| B. | A电极的电极反应式为:CH4-8e-+2H2O=CO2+8H+ | |
| C. | 燃料电池工作时H+移向左边 | |
| D. | 电解池总反应式为NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | 电离平衡常数 |
| 醋酸 | Ka=1.75×10-5 |
| 次氯酸 | Ka1=2.98×10-8 |
| 碳酸 | Ka1=4.30×10-7 Ka2=5.61×10-11 |
| 亚硫酸 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com