
| A、此陨石是一种纯度较高的硅酸盐矿石 |
| B、此陨石具有耐酸碱的特性 |
| C、陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低 |
| D、橄榄石中Fe为+2价 |


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molCH4分子共价键总数为NA |
| B、含NA个Na+的Na2O2溶于1L水中,Na+的物质的量浓度为1mol/L |
| C、常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA |
| D、1molMg与足量O2或N2反应生成MgO或Mg3N2失去电子分别为2NA和3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分液操作时,分液漏斗中下层液体从下端放出,上层液体从上口倒出 |
| B、某固体中加入稀盐酸,产生无色无味且能使澄清石灰水变浑浊的气体,证明该固体中一定含有CO32- |
| C、向待测溶液中先加入BaCl2溶液,产生白色沉淀,再加入足量盐酸,沉淀不溶解,证明溶液中一定含有SO42- |
| D、用浓硫酸配制一定物质的量浓度的稀硫酸时,将浓硫酸稀释后,应冷却至室温后再转移到容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.
肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.

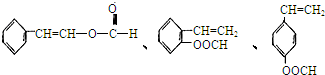
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 物质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀pH | 6.0 | 7.5 | 1,4 |
| 沉淀完全pH | 13 | 14 | 3.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com