
����Ŀ���ڻ�ѧ��Ӧ�У���������ѧ��Ӧ�ķ��Ӽ���ײ��֮Ϊ��Ч��ײ����Щ���ӳ�Ϊ����ӡ�ʹ��ͨ���ӱ�ɻ���������ṩ����������л�ܣ��䵥λ��kJmol-1��ʾ��������۲���ͼ��Ȼ��ش����⡣
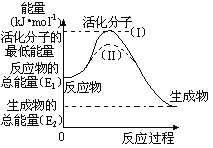
��1��ͼ�з�Ӧ��______��������������������������Ӧ���÷�Ӧ_______��������Ҫ����������Ҫ�����������ṩ�������÷�Ӧ����H=_________���ú�E1��E2�Ĵ���ʽ��ʾ����
��2����֪�Ȼ�ѧ����ʽ��H2(g)+1/2O2(g) =H2O(g) ��H= ��241.8kJmol-1���÷�Ӧ�Ļ��Ϊ167.2 kJmol-1�������淴Ӧ�Ļ��Ϊ__________��
��3������ͬһ��Ӧ��ͼ������(��)��ʵ��(I)��ȣ����_________����λ����ڻ���ӵİٷ���________����˷�Ӧ����_________����ǰ�����������������������С����������������Ϊ����ܵ�ԭ����_________________��
���𰸡����� ��Ҫ (E2��E1)kJmol-1 409.0kJmol-1 ���� ���� �ӿ� ʹ���˴���
��������
��1��ͼʾ��Ӧ�Ƿ��ȷ�Ӧ����Ӧ��ϼ�Ҫ�������������Ը÷�Ӧ��Ҫ�������ṩ��������Ӧ�ȵ����������뷴Ӧ����������E2��E1���ʴ�Ϊ�����ȣ���Ҫ��E2��E1��
��2����Ӧ�Ļ����ʹ��ͨ���ӱ�ɻ���������ṩ������ȵ�����������ͼ��������ϵ��֪���淴Ӧ�Ļ��=����Ӧ�Ļ��+��Ӧ���ʱ䣻H2(g)+1/2O2(g) =H2O(g) ��H =��241.8kJmol��1���÷�Ӧ�Ļ��Ϊ167.2kJmol��1�������淴Ӧ�Ļ��=167.2kJ/mol+241.8KJ/mol=409.0kJ/mol��
�ʴ�Ϊ��409.0kJ/mol��
��3��ͼ�������֪�����߱�ʾ���ǽ��ͷ�Ӧ�Ļ�ܣ���λ����ڻ���������෴Ӧ���ʼӿ죬���ﵽƽ��״̬��ͬ����ѧƽ�ⲻ�仯���ı�������Ǽ����˴�����
�ʴ�Ϊ�����ͣ����ӿ죻ʹ�ô�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�����ֲ�����������彡������ʮ����Ҫ�����ã�Ҳ�㷺Ӧ�������Ͳ��ϵ��Ʊ���
��1����̬��ԭ�ӵļ۵��ӹ������ʽ��________��������ͬ���������ڵ�����Ԫ�غ���ĵ�һ�������ɴ�С��˳��Ϊ______��
��2���������ʵĻ����ṹ��ԪΪ����ʮ���壬�����Է��س��ֶ��������Σ��������ʳ�Ϊ�����____��
��3��B�ļ��⻯��BH3����������ڣ����������γɽ��ȶ���B2H6�����������ӽ�ϡ�
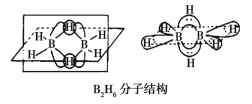
��B2H6���ӽṹ��ͼ����Bԭ�ӵ��ӻ���ʽΪ__________
�ڰ����飨NH3BH3������Ϊ�����DZ�������ʹ������֮һ�������д�����λ�����ṩ�µ��ӶԵijɼ�ԭ����__________��д��һ���백���黥Ϊ�ȵ�����ķ���_________���ѧʽ����
��4�������ᣨH3BO3��Ϊԭ�Ͽ��Ƶ����⻯�ƣ�NaBH4���������л��ϳ��е���Ҫ��ԭ����BH4-�����幹��Ϊ__________________��
��5������BP�����ܸ߶ȹ�ע����ĥ���ϣ�����Ϊ��������ı����㣬��ṹ����ʯ���ƣ������ṹ��ͼ��ʾ��
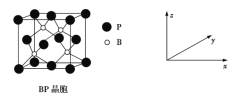
������z����ƽ���ͶӰͼ�У�Bԭ�ӹ��ɵļ�����״��__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���ѧ��ͨ������SiO2��26 Al��10 Be����Ԫ�صı�����ȷ�����������������䣬���ֲ���������������귨�����й���26 Al��10 Be��˵������ȷ���ǣ�������
A.5.2g 26 Al3+�������ĵ�����ԼΪ1.204��1024
B.10 Be��9 Be����������ͬ����������ͬ�IJ�ͬԭ��
C.26 Al3+��26 Mg2+�����������������ͺ��������������ͬ
D.10 Beԭ�Ӻ��ڵ�����������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҷ��ֶ�ұ�����е�⾫���ᴿ�ɽ��ߴ����Ʊ��ɱ�����ص���װ����ͼ��ʾ����Cu-Si�Ͻ�����Դ����950����������Һ���ν��е�⾫�����й�˵������ȷ���ǣ� ��
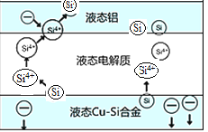
A.������Һ̬Cu-Si�Ͻ���������Һ̬���缫����
B.Һ̬���缫�븺����������Ϊ���ص�����
C.�ڸ�Һ��������Cu������Si��������Si4+������Cu2+����ԭ
D.����Һ���ε������������ⷴӦ���������߳���Ч��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2017������)��ѹ���ʻ�������������ԭ��Ϊ��Ni(s)+4CO(g)![]() Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
Ni(CO)4(g)��230��ʱ���÷�Ӧ��ƽ�ⳣ��K=2��105����֪��Ni(CO)4�ķе�Ϊ42.2�����������ʲ����뷴Ӧ��
��һ�Σ���������CO��Ӧת������̬Ni(CO)4��
�ڶ��Σ�����һ�η�Ӧ���������������������230���Ƶøߴ�����
�����ж���ȷ����
A. ����c(CO)��ƽ���������ƶ�����Ӧ��ƽ�ⳣ������
B. �ڶ��Σ�Ni(CO)4�ֽ��ʽϵ�
C. ��һ�Σ���30����50������֮��ѡ��Ӧ�¶ȣ�ѡ50��
D. �÷�Ӧ�ﵽƽ��ʱ��v����[Ni(CO)4]=4v����(CO)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��������ú����ҵ��ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֡�
��1����֪H2(g)��CO(g)��CH3OH(l)��ȼ���ȷֱ�Ϊ-285.8 kJmol-1��-283.0 kJmol-1��-726.5 kJmol-1����д���״�(CH3OH)����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��________��
��2����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K)
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K)
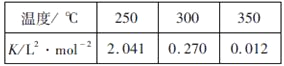
���ɱ��������ж���H_______0������>������=������<����
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ��4min�ﵽƽ��ʱ���c(CO)=0.2mol/L����ʱ���¶�Ϊ________����Ӧ����v(H2)=__________��
��3��T��ʱ����t0ʱ�̣��ϳɼ״���ӦCO(g)+2H2(g)![]() CH3OH(g)�ﵽƽ�⣬����t1ʱ�̽������������СΪԭ����һ�룬��t2ʱ���ִﵽ�µ�ƽ�⣬����ͼ�������߱�ʾt1��t2ʱ����������״����ʵ���Ũ����ʱ��仯������ʾ��ͼ_______�������������䣬�����ϱ�������������״�����
CH3OH(g)�ﵽƽ�⣬����t1ʱ�̽������������СΪԭ����һ�룬��t2ʱ���ִﵽ�µ�ƽ�⣬����ͼ�������߱�ʾt1��t2ʱ����������״����ʵ���Ũ����ʱ��仯������ʾ��ͼ_______�������������䣬�����ϱ�������������״�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ����ȡ������Ϊ100 mL��A��B����NaOH��Һ�У��ֱ�ͨ��һ������CO2����μ���0.1 mol/L�����ᣬ����CO2�����(��״��)����������������ϵ��ͼ��ʾ��
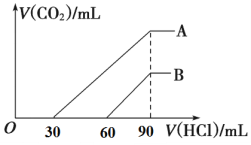
��1��A���߱�����ԭ��Һͨ��CO2 ________mL(��״��)��
��2��B���߱�����ԭ��Һͨ��CO2��������Һ�����ʵ����ʵ���֮��Ϊ__________��
��3��ԭNaOH��Һ�����ʵ���Ũ��Ϊ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʵ������������ ��������
A. ��״���£���̬�������ܶȲ����ܴ���3g/L
B. ���³�ѹ�£�̼ԭ����ͬ��Һ̬���������ٺ�3�ֽṹ
C. �����£���̬�������ܶȶ�С��ˮ���ḡ��ˮ����
D. ���������ȶ��Զ��ϲ����һ����ֽ��C��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�п��ܺ���OH-��CO32-��A1O2-��SiO32-��SO42-��HCO3-��Na+��Fe3+��Mg2+��Al3+�����ӡ��������Һ����μ���һ�����ʵ���Ũ�ȵ�������Һʱ���������ɳ��������ʵ�����������Һ������仯����ͼ��ʾ������˵����ȷ����

A. ԭ��Һ�п��ܺ���Na2SO4�����ܲ�����CO32-
B. ԭ��Һ��һ�����е�������ֻ��:OH-��A1O2-��CO32-
C. ԭ��Һ�к�CO32-��A1O2-�����ʵ���֮��Ϊ3:4
D. a-d>3/4
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com