
【题目】已知:C(s) + H2O(g) =CO(g) + H2(g) ΔH=a kJ·mol-1
2C(s) +O2(g) =2CO(g) ΔH=-220 kJ·mol-1
H-H、O=O和O-H键的键能分别为436 kJ·mol-1、496 kJ·mol-1和462 kJ·mol-1,则a为( )
A.+332B.+118C.+350D.+130
科目:高中化学 来源: 题型:
【题目】下图是中学化学中常见的有机物转化关系(部分相关物质和反应条件已略去)。
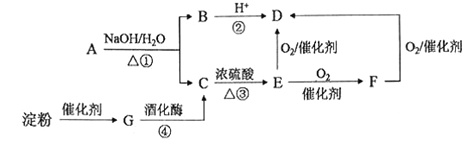
(1)写出E的官能团名称:____________;
(2)③的反应类型为 _______________;
(3)写出反应①的化学方程式:__________________________________;
(4)下列有关上述有机物的说法正确的是____________________。
A.将绿豆大小的钠块投入C中,钠块浮于液面上,并有大量气泡产生
B.可用新制Cu(OH)2鉴别C、D、F三种无色液体(实验过程可加热)
C.G能够发生酯化、水解、氧化、加成等反应
D.相同物质的量的C、E充分燃烧时消耗等量的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
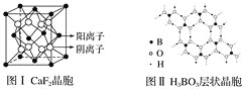
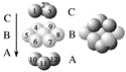
图Ⅲ 铜晶体中铜原子堆积模型
(1)图Ⅰ所示的CaF2晶体中与Ca2+最近且等距离的F-数为________________,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为__________________________________。
(2)图Ⅱ所示的物质结构中最外能层已达8电子结构的原子是________,H3BO3晶体中B原子个数与极性键个数比为____________。
(3)金属铜具有很好的延展性、导电性、传热性,对此现象最简单的解释是用________理论。
(4)三种晶体中熔点最低的是________(填化学式),其晶体受热熔化时,克服的微粒之间的相互作用为____________________________________________________________。
(5)已知两个距离最近的Ca2+核间距离为a×10-8cm,结合CaF2晶体的晶胞示意图,CaF2晶体的密度为_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到某种副产物,其原理如图所示(电极材料为石墨)。下列说法不正确的是( )
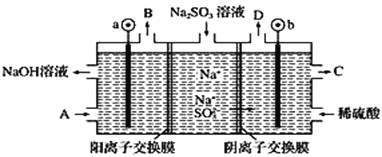
A.a电极发生还原反应,当有1 mol Na+通过阳离子交换膜时,a极生成11.2 L气体
B.若D是混合气体,则可能含有SO2、O2等成分
C.b电极上的主反应是![]() -2e-+H2O=
-2e-+H2O=![]() +2H+
+2H+
D.A溶液是稀NaOH溶液,作用是增强溶液的导电性;C溶液是较浓的硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用电解饱和食盐水生产氯气(Cl2)、烧碱和氢气的化学方程式是:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑。
2NaOH+Cl2↑+H2↑。
(1)用双线桥表示出电子转移的方向和数目__,题干中反应改写成离子方程式是__。
(2)电解食盐水的过程中,被还原的元素是__,氧化产物是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
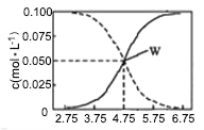
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在容积固定的V L密闭容器中加入n mol A.2n mol B,发生反应:A(g)+2B(g) ![]() 2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
2C(g) ΔH<0,反应达平衡后测得平衡常数为K,此时A的转化率为x。
(1)一段时间后上述反应达到平衡。则下列说法中正确的是________(填字母)。
A.物质A.B的转化率之比为1∶2
B.起始时刻和达到平衡后容器中的压强之比为3n∶(3n-nx)
C.当2v正(A)=v逆(B)时,反应一定达到平衡状态
D.充入惰性气体(如Ar),平衡向正反应方向移动
(2)K和x的关系满足K=________。在保证A浓度不变的情况下,扩大容器的体积,平衡______(填字母)。
A.向正反应方向移动 B.向逆反应方向移动 C.不移动
(3)该反应的逆反应速率与时间的关系如图所示。
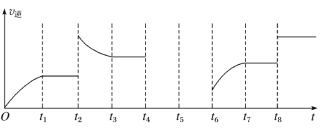
①由图可知,反应在t1.t3.t7时都达到了平衡,而t2.t8时都改变了一种条件,试判断改变的条件:t2时_______________________;t8时_________________________。
②t2时平衡向___________________(填“正反应”或“逆反应”)方向移动。
③若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘酸钾(KIO3)是重要的食品添加剂。某化学兴趣小组设计下列步骤制取KIO3,并进行产品的纯度测定。
制取碘酸(HIO3)的实验装置示意图和有关资料如下:
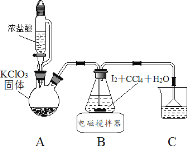
HIO3 | ①白色固体,能溶于水,难溶于四氯化碳 ②Ka=0.169mol·L-1 |
KIO3 | ①白色固体,能溶于水,难溶于乙醇 ②碱性条件下易发生反应: ClO-+ IO3- =IO4 -+ Cl- |
回答下列问题:
步骤Ⅰ用 Cl2 氧化 I2 制取 HIO3
(1)装置 A 中发生反应的化学方程式_______。
(2)装置 B 中的 CCl4 可以加快反应速率,原因_______。
(3)反应结束后,获取 HIO3 溶液的操作中,所需玻璃仪器有烧杯、________和_______。
步骤Ⅱ用 KOH 中和 HIO3 制取 KIO3
(4)该中和反应的离子方程式为_______。中和之前,应将上述 HIO3溶液煮沸至接近无色,否则中和时易生成_______(填化学式)而降低 KIO3 的产量。
(5)往中和后的溶液中加入适量_______,经搅拌、静置、过滤等操作,得到白色固体。
(6)为验证产物,取少量上述固体溶于水,滴加适量 SO2 饱和溶液,摇匀,再加入几滴淀粉溶液,溶液变蓝。若实验时,所加的 SO2 饱和溶液过量,则无蓝色出现,原因是_______。
步骤Ⅲ纯度测定
(7)取 0.1000 g 产品于碘量瓶中,加入稀盐酸和足量 KI 溶液,用 0.1000 mol·L-1Na2S2O3溶液滴定,接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失(I2+2S2O32-=2I-+S4O62-)。进行平行实验后,平均消耗 Na2S2O3 溶液的体积为 24.00 mL。则产品中 KIO3 的质量分数为_______。[M(KIO3)=214.0 g·mol-1]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
B.32.5gFeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.标准状况下,4.48L氢气、一氧化碳的混合气体完全燃烧,消耗氧分子的数目为0.1NA
D.密闭容器中2molNO与lmolO2充分反应,产物的分子数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com