
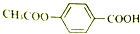
 在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )
在合适条件下与NaOH反应,最多消耗NaOH的物质的量为( )| A. | 2mol | B. | 3mol | C. | 4mol | D. | 5mol |
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质 | 用途 | 解释 |
| A | SO2 | 食品漂白剂 | SO2具有还原性 |
| B | NaClO | 消毒剂 | NaClO具有强氧化性,能杀灭细菌 |
| C | Na2CO3 | 中和过多胃酸 | Na2CO3属于碱 |
| D | 浓硫酸 | 干燥剂 | 浓硫酸具有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
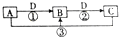 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下,它们之间的相互转化关系如图所示(反应中生成的H2O已略去).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、NO3-、SO32- | B. | CO32-、Cl-、Fe2+、NH4+- | ||
| C. | Cu2+、Cl-、SO42-、K+ | D. | Ba2+、K+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
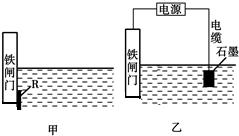 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢铁占世界钢铁年产量的四分之一.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的氢气完全燃烧分别生成气态水和液态水,前者△H大于后者 | |
| B. | 破坏反应物全部化学键所需要的能量小于破坏生成物全部化学键所需要的能量时,该反应为吸热反应 | |
| C. | 由H+(aq)+OH-(aq)=H2O(l)△H=-57.3kJ•mol-1,可知含1molH2SO4的浓硫酸与含1molNaOH的烧碱溶液混合,放出热量等于57.3kJ | |
| D. | H2的燃烧热为285.8kJ•mol-1,则氢气燃烧的热化学方程式可表示为:H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-285.8kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com