
【题目】铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定
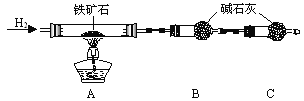
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)若将H2换成CO,则还需补充 装置。
(3)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
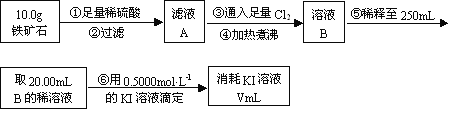
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(4)若滴定过程中消耗0.5000mol·L1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
【答案】Ⅰ.(1)防止空气中的水蒸气和CO2进入B中,影响测定结果。
(2)尾气处理 (3)24%
Ⅱ.(1)赶走溶液中溶解的过量的Cl2 (2)250mL容量瓶
(3)df (4)70% Ⅲ.Fe5O6
【解析】
试题分析:Ⅰ.(1)装置C的作用为防止空气中的水蒸气和CO2进入B中,使测得的含氧量增大;(2)CO有毒,若将H2换成CO,则还需补充尾气处理装置;(3)测的反应后装置B增重1.35g,即生成水1.35g,则铁矿石中氧的百分含量为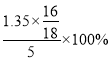 =24%;Ⅱ.(1)通入足量的氯气,溶液中溶有未反应的氯气,步骤④中煮沸的作用是赶走溶液中溶解的过量的Cl2;(2)步骤⑤配制溶液中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶;(3)碘水、Fe3+均为黄色,所以滴定过程中需加指示剂;无论如何互滴,开始就生成碘单质,滴定过程中不能利用淀粉溶液作为指示剂;滴定管用蒸馏水洗涤后再用待裝液润洗;锥形瓶不能用待测夜润洗;滴定过程中,眼睛注视锥形瓶中颜色的变化;滴定结束后,30s内溶液不恢复原来的颜色,可判断滴定终点,再读数;(4)若滴定过程中消耗0.5000mol·L1的KI溶液20.00mL,根据
=24%;Ⅱ.(1)通入足量的氯气,溶液中溶有未反应的氯气,步骤④中煮沸的作用是赶走溶液中溶解的过量的Cl2;(2)步骤⑤配制溶液中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、250mL容量瓶;(3)碘水、Fe3+均为黄色,所以滴定过程中需加指示剂;无论如何互滴,开始就生成碘单质,滴定过程中不能利用淀粉溶液作为指示剂;滴定管用蒸馏水洗涤后再用待裝液润洗;锥形瓶不能用待测夜润洗;滴定过程中,眼睛注视锥形瓶中颜色的变化;滴定结束后,30s内溶液不恢复原来的颜色,可判断滴定终点,再读数;(4)若滴定过程中消耗0.5000mol·L1的KI溶液20.00mL,根据![]() ,铁矿石中铁的百分含量为
,铁矿石中铁的百分含量为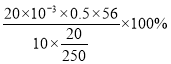 =70%。Ⅲ.设化学式为
=70%。Ⅲ.设化学式为![]() ,
,![]() ,
,![]() ,所以该铁矿石中铁的氧化物的化学式为Fe5O6
,所以该铁矿石中铁的氧化物的化学式为Fe5O6


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A. 用酸性高锰酸钾溶液鉴别甲烷和乙烯
B. 乙醇中含乙酸杂质,可加入碳酸钠溶液洗涤、分液除去
C. 除去溴苯中混有的溴单质,可加入氢氧化钠溶液洗涤、分液除去
D. 可以用溴水鉴别苯和四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂发生Cl2泄漏,以下应对措施中主要是基于Cl2的物理性质考虑的是
A. 向被污染的土壤洒石灰
B. 向远离污染源的高处撤离
C. 用浸有纯碱溶液的毛巾捂住口鼻迅速撤离
D. 来不及撤离时可用纯碱溶液浸湿的棉被堵好门窗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列仪器能用酒精灯火焰直接加热的是
①试管 ②集气瓶 ③蒸犮皿 ④量筒 ⑤烧杯 ⑥燃烧匙
A. ①②⑤ B. ①③⑥ C. ①④⑤⑥ D. ②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟是自然界中广泛分布的元素之一。由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异。
Ⅰ.化学家研究发现,SbF5能将MnF4从离子[MnF6]2-的盐中反应得到,SbF5转化成稳定离子[SbF6]-的盐。而MnF4很不稳定,受热易分解为MnF3和F2。根据以上研究写出以K2MnF6和SbF5为原料,在 423 K 的温度下制备F2的化学方程式:_________________________。

现代工业以电解熔融的氟氢化钾(KHF2)和氟化氢(HF)混合物制备氟单质,电解制氟装置如图所示。
已知KHF2是一种酸式盐,写出阴极上发生的电极反应式________________________。电解制氟时,要用镍铜合金隔板将两种气体产物严格分开的原因是___________。
Ⅱ.①卤化氢的熔沸点随相对分子质量增加而升高,而HF熔沸点高于HCl的原因是________________________。HF的水溶液是氢氟酸,能用于蚀刻玻璃,其化学反应方程式为:________________________
②已知25 ℃时,氢氟酸(HF)的电离平衡常数Ka=3.6×10-4。
某pH=2的氢氟酸溶液,由水电离出的c(H+)=___________mol/L;若将0.01 mol/L HF溶液与pH=12的NaOH溶液等体积混合,则溶液中离子浓度大小关系为:________________________。
③又已知25 ℃时,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2 mol/L HF溶液中加入 1 L 0.2 mol/L CaCl2 溶液,通过列式计算说明是否有沉淀产生:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 由H原子形成1 mol H—H键要吸收能量 B. 所有的燃烧反应都是放热反应
C. NaOH溶于水是放热反应 D. 凡经加热而发生的化学反应都是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com