
| A. | 常温下,在pH=7的醋酸钠和醋酸混合溶液中:c(CH3COO-)>c(Na+) | |
| B. | 1 mol•L-1的硫化钠溶液中,c(H+)+c(Na+)=c(OH-)+c(HS-)+c(S2-) | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5的氯化钠和稀硝酸的混合溶液中,c(Na+)=c(Cl-) |
分析 A.溶液中存在电荷守恒分析,溶液呈中性c(H+)=c(OH-);
B.溶液中存在电荷守恒,阴阳离子所带电荷总数相同;
C.醋酸溶液稀释,平衡状态下微粒浓度减小,温度不变离子积常数不变;
D.pH=5的溶液中c(H+)>c(OH-),由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),但钠离子、氯离子均来源氯化钠的电离;
解答 解:A.常温下,在pH=7的醋酸钠和醋酸混合溶液中c(H+)=c(OH-),电荷守恒式为c(H+)+c(Na+)=c(OH-)+c(CH3COO-),则c(CH3COO-)=c(Na+),故A错误;
B.稀释醋酸溶液,c(H+)减小,Kw不变,则醋酸稀释时c(OH-)增大,故B错误;
C.硫化钠溶液中,由电荷守恒可知c(Na+)+c(H+)=2c(S2-)+c(HS-)+c(OH-),由物料守恒可知$\frac{1}{2}$c(Na+)=c(S2-)+c(HS-)+c(H2S),则c(OH-)=c(H+)+c(HS-)+2c(H2S),故C错误;
D.pH=5的溶液中c(H+)>c(OH-),由电荷守恒可知,c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(NO3-),则c(Na+)<c(Cl-)+c(NO3-),但钠离子、氯离子均来源氯化钠的电离,则c(Na+)=c(Cl-),故D正确;
故选D.
点评 本题考查离子浓度大小的比较,明确溶液中电荷守恒、物料守恒、Kw的计算等即可解答,注意选项C为解答的易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 原子半径:钠>硫>氯 | B. | 氧化性:Na+>K+ | ||
| C. | 最高正化合价:氯>硫>磷 | D. | 酸性:HF>HCl>HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫用作食品防腐剂 | |
| B. | 明矾用于水的净化 | |
| C. | 盛放氢氧化钠溶液时,使用带橡皮塞的磨口瓶 | |
| D. | 在常温下用铝制贮罐贮运浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
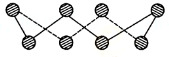 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | X | 946 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
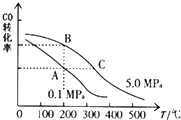 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| J | ||||
| R |
 ;元素T在周期表中位于第ⅦA族.
;元素T在周期表中位于第ⅦA族.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.130 | 0.118 | 0.090 | 0.102 | 0.073 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 单质与同浓度稀盐酸反应的速率为L<M | |
| B. | R与T形成的化合物一定能使品红溶液褪色 | |
| C. | 氢化物的稳定性为:H2T>H2R | |
| D. | 当单质L着火时,可用CO2灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
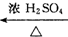 A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )
A(C4H8O3)$→_{△}^{浓H_{2}SO_{4}}$乙,甲、乙的分子式都为C4H6O2,甲能使溴的四氯化碳溶液褪色,乙为五元环状化合物,则甲不能发生的反应类型有( )| A. | 消去反应 | B. | 酯化反应 | C. | 加聚反应 | D. | 氧化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com