
| A、c(OH-)>c(HA)>c(HB)>c(H+) |
| B、c(OH-)>c(A-)>c(B-)>c(H+) |
| C、c(OH-)>c(B-)>c(A-)>c(H+) |
| D、c(OH-)>c(HB)>c(HA)>c(H+) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
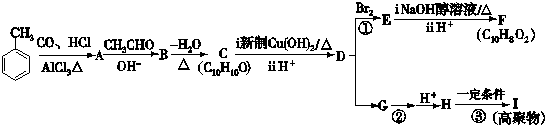
| CO、HCl |
| AlCl3△ |

| OH- |

| -H2O |
| △ |
查看答案和解析>>
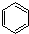
科目:高中化学 来源: 题型:
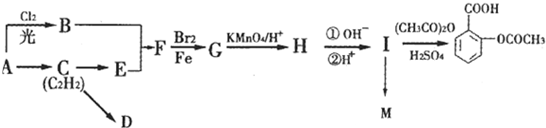
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
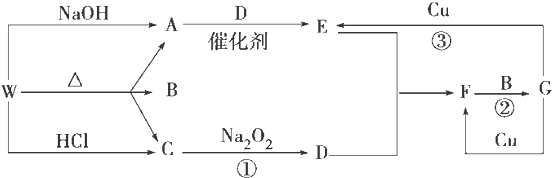
科目:高中化学 来源: 题型:
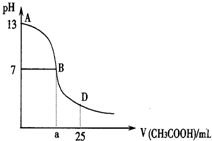 如图为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:
如图为向25mL 0.1mol?L-1NaOH溶液中逐滴滴加0.2mol?L-1CH3COOH溶液过程中溶液pH的变化曲线.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 电离平衡常数Ka |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.31×10-7 Ka2=5.61×10-11 |
| H3PO4 | Ka1=7.52×10-3 Ka2=6.23×10-8 Ka3=4.50×10-13 |
| A、温度升高,Ka值减小 |
| B、0.1 mol?L-1 CH3COOH溶液中加入少量冰醋酸,c(H+)/c(CH3COOH)将增大 |
| C、等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(CH3COONa)>pH(Na3PO4) |
| D、PO43-、HPO42-和H2PO4-在溶液中不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=3的CH3COOH溶液的浓度小于pH=2的盐酸的浓度 |
| B、向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 |
| C、将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③ | B、①③④ |
| C、②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com