
【题目】氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式_______________________________________。
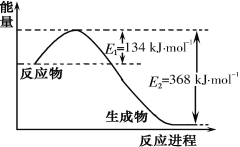
(2)已知:N2(g)+ O2(g)= 2 NO(g) △H=+180 kJ mol-1,2NO(g)+2 CO(g)= N2(g)+2 CO2(g) △H = - 746 kJmol-1,则反应CO(g) +1/2O2(g)= CO2(g)的△H=_______ kJmol-1。
【答案】NO2(g)+CO(g)= CO2(g)+NO(g) △H = -234 kJ·mol-1 -283
【解析】
(1)根据能量变化图,反应热等于=正反应的活化能减去逆反应的活化能,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ;
(2)根据盖斯定律计算。
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)已知:①N2(g)+O2(g)=2NO(g)△H=+180kJmol-1,②2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=-746kJmol-1,据盖斯定律,(①+②)/2得:CO(g) +1/2O2(g) = CO2(g),则△H=-283kJmol-1,故答案为:-283。


科目:高中化学 来源: 题型:
【题目】以红土镍矿(主要成分为NiS、FeS和SiO2等)为原料制备兰尼镍的工艺流程如下所示。
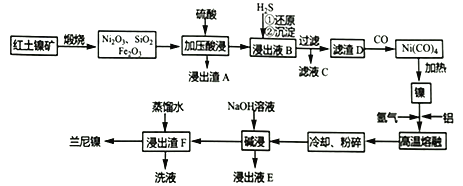
(1)形成Ni(CO)4时碳元素的化合价没有变化,则Ni(CO)4中的Ni的化合价为___________。
(2)Ni2O3有强氧化性,加压酸浸时有气体产生且镍被还原为Ni2+,则产生的气体为______(填化学式)。
(3)滤渣D为单质镍、硫的混合物,请写出向浸出液B中通入H2S气体时所有反应的离子方程式:__________________________,_________________________。
(4)已知:3Fe2++2[Fe(CN)6]3-==Fe3[Fe(CN)6]2↓(蓝色沉淀);4Fe3++3[Fe(CN)6]4-==Fe4[Fe(CN)6]3↓(蓝色沉淀)。下列可以用于检验滤液C中金属阳离子的试剂有____________(填标号)
a.KSCN溶液 b.K3[Fe(CN)6] c.K4[Fe(CN)6] d.苯酚
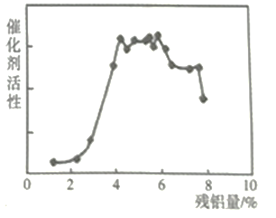
(5)兰尼镍是一种带有多孔结构的细小晶粒组成的镍铝合金。碱浸镍铝合金后,残铝量对兰尼镍的催化活性有重大影响,根据下图分析,残铝量在_____范围内催化活性最高,属于优质产品。
(6)仿照下面示例,设计从浸出液E回收氧化铝的流程:浸出液E_________________。
(示例:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为中学常见的混合物分离或提纯的基本装置,请回答:
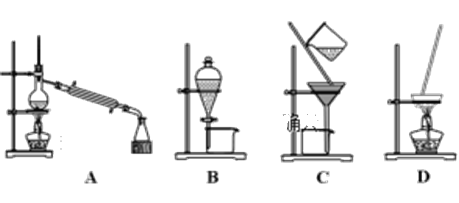
(1)分离植物油和水,选择装置______(填序号),主要使用仪器名称__________;
(2)分离乙二醇和丙三醇的混合溶液,选择装置______(填序号)。
物质 | 熔点 (摄氏度) | 沸点(摄氏度) | 密度(g/cm-3) | 溶解性 |
乙二醇 | -11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇 | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比例互溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气净化中的一个反应如下:NO(g)+CO(g)![]() 1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
1/2N2(g)+CO2(g) ΔH=-373.4 kJ·mol-1,在恒容的密闭容器中,反应达到平衡后,改变某一条件,下列示意图正确的是
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一应用前景广阔的纳米材料甲,其由A、B两种短周期非金属元素组成,难溶于水,且硬度大,熔点高。取材料甲与熔融的烧碱反应,生成一种含A元素的含氧酸盐乙和一种含B元素的气体丙,丙能使湿润的红色石蕊试纸变蓝;乙能溶于水,加盐酸产生白色沉淀,盐酸过量沉淀不溶解。
(1)甲的化学式为____________,其晶体属于____________晶体。
(2)乙的水溶液可以用来做________________________(写出一种用途)。
(3)B元素的一种氢化物丁,相对分子质量为32,常温下为液体,其燃烧放热多且燃烧产物对环境无污染,因此可用作火箭燃料、燃料电池燃料等。则
①丁的电子式为_____。
②丁可由次氯酸钠与过量氨气反应制得,其化学方程式________________________。
甲的制备过程中氨气需要过量的理由是____________________________________。
③丁的水溶液呈弱碱性,室温下其电离常数K1≈1.0×10-6,则0.01 mol·L-1丁水溶液的pH等于____________(忽略丁的二级电离和H2O的电离)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~H均为中学化学中常见的物质,A是黄绿色气体、B、H是无色无味气体。(反应中生成的水已略去)
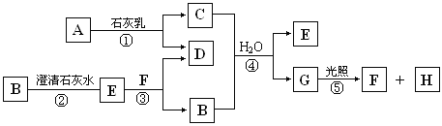
请回答以下问题:
(1)A是________,H是________。(填化学式)
(2)C物质在日常生活中可作________剂。
(3)F分子所含共价键类型是________;写出B的电子式_________。
(4)写出反应①的化学方程式:____________________________;写出反应③的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石等自然界存在的碳酸盐类铜矿的化学组成为xCuCO3·yCu(OH)2(x、y为正整数,且x≤3,y≤2)。
(1)现有两份等量的某碳酸盐类制矿样品,一份加足量盐酸,产生3.36L标准状况下的CO2气体,另一份加热完全分解得到20gCuO,则该碳盐类铜矿的化学组成中x:y=____。
(2)设某碳酸盐类铜矿样品质量为ag,含铜质量为bg,加酸完全分解得到标准状况下CO2气体VL,则a、b、V的代数关系式是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10mL0.1mol·L-1NaOH溶液中加入同体积、同浓度的HAc溶液,反应后溶液中各微粒的浓度关系错误的是 ( )
A. C(Na+)>C(Ac-)>C(H+)>C(OH-) B. C(Na+)>C(Ac-)>C(OH-)>C(H+)
C. C(Na+)=C(Ac-)+C(HAc) D. C(Na+)+C(H+)=C(Ac-)+C(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下。下列说法正确的是( )
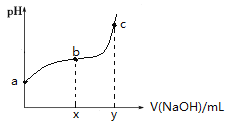
A.若a点pH=4,且c(Cl-)=m c(ClO-),则Ka(HClO)=![]()
B.若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中:c(OH-)—c(H+)=2c(Cl-)+c(HClO)
D.b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com