
反应A(g)+B(g)  C(g)+D(g)过程中的能量变化如图所示,
C(g)+D(g)过程中的能量变化如图所示,
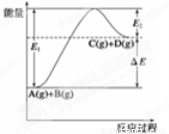
①正反应为放热反应,②反应物总能量低于生成物总能量,③反应物的总键能小于生成物的总键能,④1molA与1molB充分反应后,能量变化为ΔE,⑤加入催化剂后,反应加快,ΔE减小,⑥反应达到平衡时,升高温度,A的转化率增大,⑦升高温度可增大正反应速率,降低逆反应速率,⑧E2是反应C(g)+D(g)  A(g)+B(g) 的活化能,以上有关说法正确的是
A(g)+B(g) 的活化能,以上有关说法正确的是
A.⑤⑥⑦⑧ B.①②③④ C.①③⑤⑦ D.②⑥⑧
D
【解析】
试题分析:①由于生成物的能量高于反应物的能量,所以该反应的正反应为吸热反应,错误;②从图示可知反应物总能量低于生成物总能量,正确;③反应物的总键能大于生成物的总键能,错误;④反应过程的能量变化既与物质的多少有关,也和物质的状态有关,错误;⑤加入催化剂后,反应加快,但是ΔE不变,错误;⑥由于该反应的正反应是吸热反应,所以反应达到平衡时,升高温度,根据平衡移动原理,化学平衡向吸热反应方向移动,即向正反应方向移动,所以A的转化率增大,正确;⑦升高温度可增大正反应速率和逆反应速率,由于正反应速率增大的多余逆反应速率增大的倍数,所以平衡正向移动,错误;⑧E2是反应C(g)+D(g)  A(g)+B(g) 的活化能,正确。故说法正确的是②⑥⑧,所以选项是D。
A(g)+B(g) 的活化能,正确。故说法正确的是②⑥⑧,所以选项是D。
考点:考查反应热与物质的能量、状态、键能等关系的知识。


科目:高中化学 来源:2014-2015河北保定某重点中学同步作业(必修1苏教版)1.3原子结构 题型:选择题
已知R2+核外有a个电子,b个中子。表示R原子符号正确的是 ( )
A.R B.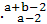 R C.
R C.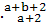 R D.
R D. R
R
查看答案和解析>>
科目:高中化学 来源:2014-2015学年黑龙江省高二上期开学考试化学试卷(解析版) 题型:选择题
已知胆矾溶于水时溶液温度降低,室温下将1mol无水硫酸铜制成溶液时放出热量为Q1kJ,又知胆矾分解的热化学方程式为CuSO4?5H2O(s) === CuSO4(s)+5H2O(l) △H=+Q2 kJ·mol?1则Q1、Q2的关系为 ( )
A.Q1<Q2 B. Q1>Q2 C. Q1=Q2 D. 无法确定
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:实验题
(14分)用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
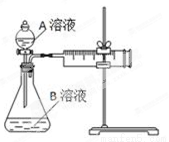
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
② | 20 mL 0.2 mol·L-1H2C2O4溶液 | 30 mL 0.01 mol·L-1KMnO4溶液 |
(1) 该实验探究的是 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是① ②(填“>”、“<”或“=”)。
(2) 若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=_______mol·L-1。(假设混合溶液体积为50 mL)
(3) 除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率。
(4) 小组同学发现反应速率总是如下图,其中t1~t2时间内速率变快的主要原因可能是:
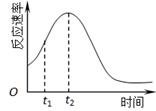
①产物Mn2+是反应的催化剂、② 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(B类)试卷(解析版) 题型:选择题
对于任何一个平衡体系,采用以下措施,一定会使平衡移动的是
A.加入一种反应物 B.升高温度
C.对平衡体系增加压强 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(A类)试卷(解析版) 题型:填空题
(20分)(1)硫酸是重要的化工材料,二氧化硫生成三氧化硫是工业制硫酸的重要反应之一。
2SO2(气)+ O2 (气)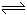 2SO3(气)△H<0。
2SO3(气)△H<0。
根据化学平衡原理来确定的条件或措施有 (填序号)。
A 为提高SO2的转化率,加入过量的空气
B 含SO2的炉气在进行氧化反应以前必须净化,其目的就是为了除尘、以防催化剂中毒
C 使用作V2O5催化剂
D.反应条件不使用很高温度
E.氧化反应在常压下进行
(2)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系
如下图所示。根据图示回答下列问题:
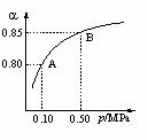
①将2 mol SO2和1 mol O2置于10L密闭容器中,反应达到平衡后,体系的总压为0.10MpPa,该反应的平衡常数为 。
②平衡状态由A变到B时,平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(3)若实验室在催化剂存在的条件下,向某密闭容器中充入1.6molSO2和0.8molO2,此时容器体积为100L,在温度和压强不变条件下反应达到平衡,SO3体积分数为0.50,SO2的转化率为α。
①达平衡时混合气体的体积为_________,α为_________;
②若保持温度和压强不变,平衡时再充入1 molSO3,则平衡时SO2体积分数为 ;
③若起始时充入x mol SO2、y molO2和z mol SO3,在,反应达平衡时,测得混合气体的体积为120 L,SO3体积分数仍为0.5。则x、 y应满足的关系式为 ,x、z应满足的关系式为 。
④在同样的温度下,若条件为恒温恒容(100L),在此容器中加入1.6molSO2和0.8molO2到达平衡时,SO2的转化率_______α(填“大于”、“小于”或“等于”)
(4)硫酸工业的尾气中含有少量的SO2,常用氨水吸收后在加硫酸,回收SO2同时得到化肥硫酸铵,硫酸铵溶液中各离子物质的量浓度由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北咸宁鄂南高级中学高二起点考试化学(A类)试卷(解析版) 题型:选择题
在Na2HPO4溶液中,存在着下列平衡:HPO42-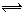 H++PO43-;HPO42-+H2O
H++PO43-;HPO42-+H2O 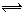 H2PO4-+OH-;已知该溶液呈碱性。欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
H2PO4-+OH-;已知该溶液呈碱性。欲使溶液中的HPO42-、H+、PO43-浓度都减小,可采取的方法是( )
A.加石灰水 B.加盐酸 C.加烧碱 D.用水稀释
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏江阴高一上暑期学习反馈(开学检测)化学试卷(解析版) 题型:填空题
(8分)用于分离或提纯物质的方法有: ①过滤 ②升华 ③加热分解 ④蒸馏
下列各组混合物的分离或提纯应选用上述哪一种方法最合适?(填序号)
(1)除去Ca(OH)2溶液中悬浮的CaCO3颗粒_________;
(2)除去乙酸中溶解的微量食盐,用_________;
(3)除去固体碘中混有的少量NaCl固体,用________;
(4)除去氧化钙中的CaCO3,用_________。
查看答案和解析>>
科目:高中化学 来源:2013-2014黑龙江省高二下学期期末考试化学试卷(解析版) 题型:选择题
R、X、Y、Z是四种元素,其常见化合价均为+2,且X2+与单质R不反应;X2++Z=X+Z2+,Y+Z2+=Y2++Z,这四种离子被还原成0价时表现的氧化性大小顺序为( )
A.R2+﹥X2+﹥Z2+﹥Y2+ B.X2+﹥R2+﹥Y2+﹥Z2+
C. Y2+﹥Z2+﹥R2+﹥X2+ D.Z2+﹥X2+﹥R2+﹥Y2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com