
����Ŀ���ڳ����£�Fe��ˮ������Ӧ�����ڸ����£�Fe��ˮ�����ɷ�����Ӧ��Ӧ������װ�ã���Ӳ�ʲ������з��뻹ԭ���ۺ�ʯ���Ļ������ȣ���ͨ��ˮ�������Ϳ�����ɸ����¡�Fe��ˮ�����ķ�Ӧʵ�顱��

��ش��ʵ���е����⡣
��1��д���÷�Ӧ�ķ�Ӧ����ʽ��________________________________________����ָ����������ԭ��Ӧ�Ļ�ԭ����_____________����������____________��
��2��ʵ��ǰ���������װ�ý��������Լ�飬����������______________________��
��3��Բ����ƿ��ʢװ��ˮ����װ�����Ⱥ����Ҫ������________________________����ƿ�ײ������˼�Ƭ���Ƭ�����Ƭ������__________________________________��
��4���ƾ��ƺ;ƾ���Ƶ�ȼ��˳����________________________________________��
��5���������ʢװ�ǵ�������___________________��������___________________��
���𰸡�3Fe+4H2O(g)![]() Fe3O4+4H2 Fe H2O �ڲ����ܿ�A����һ���齺�ܣ��齺��ͷ����һ�β����ܣ������ܿ�û��ˮ�У��þƾ��ƻ�������ƿ�ײ�������ܹ��۲쵽û��ˮ�еIJ����ܿ��������ݳ���ֹͣ���Ⱥ���������ˮ���������ҽϳ�ʱ��ˮ�������䣬���������װ������������ ΪӲ�ʲ�������Fe��ˮ�����ķ�Ӧʵ���ṩ�������ϵ�ˮ���� ��ֹ�����¹ʵķ��� �ȵ�ȼ�ƾ��ƣ�����ˮ�������ٵ�ȼ�ƾ���ƣ���ֹ�ȵ�ȼ�ƾ���������µ�Fe��O2�ķ�Ӧ ��ʯ�Ҹ���� ��ȥ��Ӧ������H2�е�ˮ����
Fe3O4+4H2 Fe H2O �ڲ����ܿ�A����һ���齺�ܣ��齺��ͷ����һ�β����ܣ������ܿ�û��ˮ�У��þƾ��ƻ�������ƿ�ײ�������ܹ��۲쵽û��ˮ�еIJ����ܿ��������ݳ���ֹͣ���Ⱥ���������ˮ���������ҽϳ�ʱ��ˮ�������䣬���������װ������������ ΪӲ�ʲ�������Fe��ˮ�����ķ�Ӧʵ���ṩ�������ϵ�ˮ���� ��ֹ�����¹ʵķ��� �ȵ�ȼ�ƾ��ƣ�����ˮ�������ٵ�ȼ�ƾ���ƣ���ֹ�ȵ�ȼ�ƾ���������µ�Fe��O2�ķ�Ӧ ��ʯ�Ҹ���� ��ȥ��Ӧ������H2�е�ˮ����
��������
����ˮ�����ڼ��������·���������ԭ��Ӧ����������������������ʵ��ʱ�ȼ��Ⱦƾ��ƣ����ṩˮ���������ų���������ֹ����������Ӧ�������������ü�ʯ�Ҹ���õ�ȼ�ķ�������������ע���ֹ���������屬ը���Դ˽����⡣
(1)����ˮ��������������ԭ��Ӧ��3Fe+4H2O(g)![]() Fe3O4+4H2�����ݻ��ϼ��������ж��������ͻ�ԭ��������Ԫ�صĻ��ϼ����ߣ���������ԭ����ˮ����Ԫ�صĻ��ϼ۽��ͣ�ˮ����������
Fe3O4+4H2�����ݻ��ϼ��������ж��������ͻ�ԭ��������Ԫ�صĻ��ϼ����ߣ���������ԭ����ˮ����Ԫ�صĻ��ϼ۽��ͣ�ˮ����������
(2)ʵ��ǰ���������װ�ý��������Լ�飬��鷽�����ڲ����ܿ�A����һ���齺�ܣ��齺��ͷ����һ�β����ܣ������ܿ�û��ˮ�У��þƾ��ƻ�������ƿ�ײ�������ܹ��۲쵽û��ˮ�еIJ����ܿ��������ݳ���ֹͣ���Ⱥ���������ˮ���������ҽϳ�ʱ��ˮ�������䣬���������װ�����������ã�
(3)��Ϊ��Ӧ��Ϊˮ��������������������ȵ�Ŀ�ľ����ṩˮ��������ƿ�ײ�Ӧ���ȷ������Ƭ�������Ƭ��Ŀ���Ƿ�ֹ���У�
(4)�����е�������ͽ�������Ӧ��Ϊ��ֹ�������ţ�Ӧ���ȵ�ȼ�ƾ��ƣ�����ˮ����������ȥװ���ڿ��������ٵ�ȼ�ƾ���ƣ��ɷ�ֹ��������ʱ�������������Ӧ��
(5)�����Ӧֻ��ʢװ����������һ��Ϊ��ʯ�ң����ڸ���������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����ԭ��ص�װ��ͼ����ش�

��1����CΪϡH2SO4��Һ��������ָ�뷢��ƫת��B�缫����ΪFe������������A�缫��ʹ��___________��A�Ϸ����ĵ缫��ӦʽΪ______________________________��
��2����CΪCuCl2��Һ��Zn�Ǹ�����Cu������____��Ӧ���缫��ӦΪ_____________��
��3��CO��H2��Ӧ�����Ʊ�CH3OH��CH3OH����Ϊȼ��ʹ�ã���CH3OH��O2����γɵ����ӽ���Ĥȼ�ϵ�صĽṹʾ��ͼ��ͼ��

����ܷ�ӦΪ2CH3OH+3O2=2CO2+4H2O��c�缫Ϊ____�����缫��Ӧ����ʽΪ______������·��ת��2mol���ӣ������ĵ�O2�ڱ�״���µ����Ϊ____ L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڹ�ҵ��������Ҫ����;��ij��ȤС����ʵ������ģ�ҵ���������Ʊ���ˮ�Ȼ���(��ˮAlCl3����ʪ������������������)����������װ���Ʊ���

(1) װ��B��ʢ��__________��Һ����������_________��F�е���______��Һ����������_____________��
(2)װ��Aʵ�鿪ʼǰ��Ӧ��_________���������IJ���������_____________(�����)��
A������ƿ�м���MnO2��ĩ B������ C������ƿ�м���Ũ����
(3)��С��ͬѧ�����ϵ�֪��������ع����Ũ������Ҳ������������ͬʱ�д���ClO2���ɣ�ClO2�е�Ϊ10�����۵�Ϊ��59����Һ��Ϊ��ɫ��Cl2�е�Ϊ��34����Һ̬Ϊ����ɫ��
��������ʵ����֤Cl2�к���ClO2���ռ�һ�Թ����壬���Ͻ����������ˮ�����������____________����˵��Cl2�к���ClO2 ��
�ڽ���������(Na2S2O8)Һ������������(NaClO2)�п��Ʊ�ClO2��NaClO2��ClԪ�صĻ��ϼ���___________���÷�Ӧ���������ͻ�ԭ�������ʵ���֮��Ϊ________��
�۽�ClO2ͨ��MnSO4��Һ����Һ�пɼ�Cl-��ͬʱ�к�ɫMnO2�������ɡ��÷�Ӧ�����ӷ���ʽΪ�� ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�е������DZ�ʾ��������һ��ʱ��2NO��O2![]() 2NO2 ��H��0 ����Ӧ��NO��ת�������¶ȵĹ�ϵ���ߣ�ͼ�б���a��b��c��d�ĵ㣬���б�ʾδ�ﵽƽ��״̬����v(��)>v(��)�ĵ���
2NO2 ��H��0 ����Ӧ��NO��ת�������¶ȵĹ�ϵ���ߣ�ͼ�б���a��b��c��d�ĵ㣬���б�ʾδ�ﵽƽ��״̬����v(��)>v(��)�ĵ���

A. a�� B. b�� C. c�� D. d��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���Թ���ʢװ���Ǻ���ɫ���壨�����ǻ�������������ʢ��ˮ��ˮ����ʱ���Թ���ˮ�������������ܳ����Թܣ������Թ��ڹ����������Թ۲쵽�Թ���ˮ��������������������ظ����Թ�����ȫ��ˮ������ԭ���Թ���ʢװ�Ŀ�����ʲô����

A.������N2��NO2�Ļ������B.ֻ����NO2һ������
C.������N2��NO�Ļ������D.������O2��NO2�Ļ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˽�����K2SO4��MgSO4��KNO3�����ᴿ�����Ƶô�����KNO3��Һ(E)��ijѧ���������ʵ�鷽����

(1)��������Ҫ�ǽ������ܽ⣬�����õ���Ҫ����������_______��_______��
(2)������ ~ �����ӵ��Լ�˳�����Ϊ_______��_______��_______(��д�Լ��Ļ�ѧʽ)��
(3)����ж�SO42���ѳ���_____________
(4)ʵ������в����Ķ�γ���_____(ѡ������Ҫ����������Ҫ��)��ι��ˣ�������__________��
(5)��ͬѧ��ʵ����Ʒ�����ij���������ܣ���˵������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧ��Ӧ����ʶ��ȷ���� ( ����)
A.������ԭ��Ӧ���Ƿ��ȷ�Ӧ
B.��ѧ��Ӧ������һ���л�ѧ���Ķ��Ѻ��γ�
C.���������仯�����ʱ仯���ǻ�ѧ�仯
D.��ѧ��Ӧ�����У����ӵ��������Ŀһ�������ı�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2A(g)+B(g)��![]() 3C(g)+4D(g)��Ӧ�У���ʾ�÷�Ӧ���������ǣ�������
3C(g)+4D(g)��Ӧ�У���ʾ�÷�Ӧ���������ǣ�������
A. v(A)��0.5mol/L.s B. v(B)��0.3mol/L.s
C. v(c)��0.8mol/L.s D. v(D)��30mol/L.min
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����22.4 g�������뺬HNO3 0.8 mol��������Һ�У���Ӧ���ɵ���������ʵ���(x)(����HNO3�Ļ�ԭ����ֻ��NO)���������۵����ʵ���(y)�仯��ϵ����ȷ����
A. 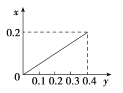 B.
B. 
C.  D.
D. 
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com