
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
【答案】D
【解析】A、对应的盐溶液的pH越大,酸根离子水解程度越大,酸越弱,则将等浓度的CH3COOH和HClO溶液,CH3COOH的酸性强,则pH小的是CH3COOH,选项A错误;B、碳酸钠中CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,H2O
H2CO3+OH-,H2O![]() H++OH-,碳酸氢钠溶液中HCO3-
H++OH-,碳酸氢钠溶液中HCO3-![]() CO32-+H+,HCO3-+H2O
CO32-+H+,HCO3-+H2O![]() H2CO3+OH-,H2O
H2CO3+OH-,H2O![]() H++OH-,所以两种溶液中粒子种类相同,选项B错误;C、易水解的盐能促进水的电离,水解程度越大,对水的电离的促进程度越大,则四种溶液中,水的电离程度③>④>②>①,选项C错误;D、NaHCO3溶液中存在物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),选项D正确。答案选D。
H++OH-,所以两种溶液中粒子种类相同,选项B错误;C、易水解的盐能促进水的电离,水解程度越大,对水的电离的促进程度越大,则四种溶液中,水的电离程度③>④>②>①,选项C错误;D、NaHCO3溶液中存在物料守恒:c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3),选项D正确。答案选D。


科目:高中化学 来源: 题型:
【题目】(1)25℃时,0.05mol/LH2SO4溶液的pH=______ ,0.01mol/LNaOH溶液的pH=______ 。
(2)某温度下纯水的c(H+)=4.0×10-7mol/L,则此溶液中的c(OH-)=_______;若温度不变,滴入稀盐酸,使c(H+)=2.0×10-4mol/L,则此溶液中由水电离产生的c(H+)=_________。
(3)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s) ![]() Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)·c2(OH-)=2×10-20。某硫酸铜溶液里c(Cu2+)=0.02 mol·L-1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《京华时报》2016年8月24报道:京东自营的部分产品和一号店的部分产品二氧化硫严重超标,下列有关二氧化硫的说法不正确的是( )
A.二氧化硫有毒,不可以应用于任何食品行业
B.二氧化硫是一种食品添加剂,在国家标准范围内使用时安全的
C.二氧化硫可以是品红褪色
D.二氧化硫可以用于工业漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是生物体细胞内部分有机化合物的概念图,请回答下列问题。
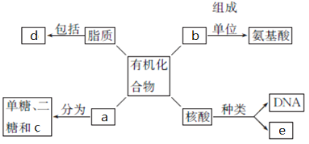
(1)小麦种子中的储能物质c是__________,人和动物细胞中的储能物质c是____________。
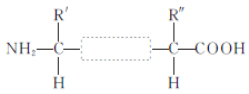
(2)两个氨基酸发生脱水缩合反应时,产物是__________和__________,下图方框内的结构简式是____________。
(3)b结构的多样性决定其功能的多样性,如作为结构物质、免疫功能、___________、___________、信息传递等。
(4)SARS病毒的遗传信息贮存在e中,e物质初步水解的产物是________________;在小麦叶肉细胞中,e主要存在于____________中。
(5)d中构成生物膜的主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于同系物的是( )
A. ![]() 与
与![]() B. CH3CH2Cl与CH2ClCH2CH2Cl
B. CH3CH2Cl与CH2ClCH2CH2Cl
C. C2H5OH与CH3OH D. CH3CH2CH3与CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用MnO2氧化密度为1.19g·cm-3、溶质质量分数为36.5%的HCl溶液。反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)17.4gMnO2能与_____摩尔HCl发生上述反应?有______摩尔HCl被氧化?
(4)若在标准状况下产生4.48L Cl2,则反应中转移电子_______摩尔。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝是常用的有机化工试剂,易水解、易升华。实验室用以下装置制取少量氯化铝,反应原理为2Al+6HCl(g) ![]() 2AlCl3+3H2。以下说法正确的是
2AlCl3+3H2。以下说法正确的是
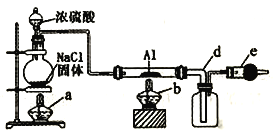
A. 圆底烧瓶中发生反应:NaCl+H2SO4(浓) ![]() HCl↑+NaHSO4
HCl↑+NaHSO4
B. 粗导管d也可换成细导管
C. e中试剂可选用碱石灰、无水氧化钙或五氧化二磷
D. 为了减少HCl的浪费,实验开始时先点燃b处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硒(SeO2)是一种氧化剂,其被还原后的单质硒可能成为环境污染物,通过与浓HNO3或浓H2SO4反应生成SeO2以回收Se。
已知: ① Se+2H2SO4(浓)=2SO2↑+SeO2+2H2O ② SO2+SeO2+ H2O ![]() Se + SO42-+ H+
Se + SO42-+ H+
(1)依据Se与浓H2SO4的反应,写出Se和浓HNO3(还原产物为NO2)反应的化学方程式:__________________。
(2)Se与浓HNO3的反应中,氧化剂是_______, 反应中被还原的元素是_______。当有标准状况下33.6LNO2气体生成时,转移电子的物质的量是________mol。
(3)依据反应①②, 判断SeO2、浓H2SO4、SO2的氧化性由强到弱的顺序是__________。
(4) 配平反应②, 并用双线桥法标出电子转移的方向和数目:_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。
(2)利用下图装置,可以模拟铁的电化学防护。
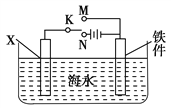
①开关K断开时,且若为生铁,则铁件主要发生_____腐蚀;若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜(含锌等杂质),容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加127 g时,X电极溶解的铜的质量________127 g(填“<”“>”或“=”)。铁件表面镀铜可有效防止铁被腐蚀,如果铁件部分未镀上铜,或镀层破损,镀铜铁比镀锌铁反而更易被腐蚀,请简要说明原因:__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com