
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
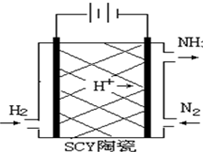 科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.
科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是反应式为N2+6H++6e-=2NH3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | 元素性质或原子结构 |
| T | 第二层上的电子数是第一层的3倍 |
| R | 与T 同一族 |
| L | L2+与T2-的核外电子数相等 |
| Z | 元素最高正价是+3价,与L同周期 |
| A. | 氢化物的稳定性为H2T<H2R | |
| B. | 单质与稀盐酸反应的速率为L<Z | |
| C. | Z与T形成的化合物具有两性 | |
| D. | L与R通过离子键形成的化合物阴阳离子的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,1mol任何气体物质的体积都约为22.4L | |
| B. | 1mol气体的体积约为22.4L | |
| C. | 标准状况下,1molO2和N2混合气(任意比)的体积约为22.4L | |
| D. | 任何条件下,气体的摩尔体积都是22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (g)+CO2(g)?
(g)+CO2(g)?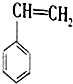 (g)+CO(g)+H2O(g)△H
(g)+CO(g)+H2O(g)△H| 化学键 | C-H | C-C | C=C | C=O | CO | O-H |
| 键能/kJ/mol | 413 | 348 | 615 | 745 | 1076 | 463 |
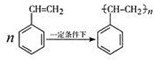 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
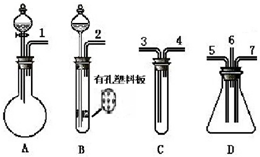 根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:
根据下面提供的仪器和试剂,完成验证SO2既有氧化性又有还原性的实验.可选用的仪器如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com