
【题目】下列热化学方程式中,正确的是( )
A.甲烷的燃烧热为 890.3 kJmolˉ1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=+890.3 kJmolˉ1
B.稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H++OH-=H2O; △H =-57.3 kJmolˉ1
C.已知 H2 燃烧热为 142.9kJmolˉ1 ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H =-285.8 kJmolˉ1
D.500℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ;△H=-38.6kJ· mol-1
2NH3(g) ;△H=-38.6kJ· mol-1
【答案】C
【解析】
A. 燃烧热是1mol纯物质完全燃烧生成稳定的氧化物时放出的热量;
B. 热化学方程式在书写时要标出物质的聚集状态;
C. 1mol H2 燃烧放热142.9 kJ,2mol H2 燃烧放热571.6 kJ;
D. 合成氨为可逆反应,0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,生成的氨气的物质的量小于1mol。
A. 甲烷的燃烧热为 890.3 kJmolˉ1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H=-890.3 kJmolˉ1,A项错误;
B. 稀盐酸和稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(l); △H =-57.3 kJmolˉ1,B项错误;
C. H2 燃烧热为 142.9kJmolˉ1 ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H =-285.8 kJmolˉ1,C项正确;
D. 合成氨为可逆反应,0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,生成的氨气的物质的量小于1mol,因此热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) ;△H<-38.6kJ· mol-1;
2NH3(g) ;△H<-38.6kJ· mol-1;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A.反应![]() 在任何条件下都不会自发进行
在任何条件下都不会自发进行
B.溶液![]() 加水稀释后,溶液中
加水稀释后,溶液中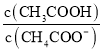 的值减小
的值减小
C.温度升高,反应物的活化分子数增多,主要因素是分子的运动加快,反应速率加快
D.![]() 液中加入少量
液中加入少量![]() 固体,
固体,![]() 水解程度减小,溶液的pH减小
水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向等体积的不含O2、含有O2的0.1mol·L1BaCl2溶液中通入SO2,探究体系中物质间的相互作用,实验记录如下。(已知:pH越小,溶液酸性越强)
pH变化 |
|
溶液中是否产生沉淀 | 不含O2的BaCl2溶液中没有白色沉淀,含有O2的BaCl2溶液中产生白色沉淀。 |
下列说法不正确的是
A.a所示溶液的pH降低的原因:SO2与H2O反应生成H2SO3,溶液的c(H+)增大
B.b所示溶液中发生反应:2Ba2++O2+2SO2+2H2O=2BaSO4↓+4H+
C.b比a所示溶液的pH小的原因:Ba2++SO2+H2O=BaSO3↓+2H+
D.SO2通入不含O2的BaCl2溶液后,再通入NH3,产生BaSO3沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z、Q是原子序数依次增大的前四周期元素。W是宇宙中最丰富的元素;X、Z 元素原子基态时,核外电子均排布在3个能级上,且它们的价电子层上均有两个未成对电子;向含Q2+的溶液中滴加氨水,形成蓝色沉淀,再滴加氨水,沉淀溶解,得到深蓝色溶液。回答下列问题:
(1)第一电离能 Y ________________ Z,电负性 Y ________________ Z(填“大于”、“小于”或“等于”)。
(2)写出与XZ分子互为等电子体的一种离子的化学式________________。
(3)若向含有Q2+ 的硫酸盐溶液中滴加过量氨水,得到深蓝色溶液后再加乙醇,有_____________色晶体析出,该晶体中,中心离子的电子排布式为________________,配体为________________。
(4)已知 W 、 Y 形成的一组二元化合物化学式:![]() 、
、![]() 、
、![]() 、
、![]() 其中,
其中,![]() 分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
分子中 Y 原子的杂化类型为________________;这组化合物的通式为________________。W、Y 形成的化合物的种类比 W、X 形成的化合物的种类________________ 填“多”或“少”。
(5)Q单质的晶体属于面心立方最密堆积。已知 Q 单质的密度是 ![]() ,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
,NA表示阿伏加德罗常数的值,Q 的相对原子质量为 M,则 Q 晶体中最邻近的原子核间距为________________ cm 用含 M、d、NA 的代数式表示 。Q原子在晶胞中的空间利用率为________________(用含N的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应2N2O5(g) → 4NO2(g) + O2(g), R.A.Ogg提出如下反应历程:
第一步:2N2O5 ![]() NO2 +NO3 快速平衡;
NO2 +NO3 快速平衡;
第二步:NO2 +NO3 →NO2 +NO+ O2 慢反应;
第三步:NO+ NO3 →2NO2 快反应;其中可近似认为第二步反应不影响第一步平衡。下列表述正确的是
A.υ逆(第一步) < υ正(第二步)B.反应的中间产物只有NO
C.第二步中NO2 和NO3 碰撞部分有效D.第三步正反应的活化能较高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应 2A(s)+3B(g) ![]() C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g);ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
A.加入催化剂,B的转化率提高
B.升高温度,平衡向逆反应方向移动,v(正)减小
C.压强增大一倍,平衡不移动,v(正)、v(逆)不变
D.恒温恒容充入 Ne,容器内压强增大,V(正)、V(逆)均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列电解质溶液的说法中,正确的是
A.常温下,![]() 与
与![]() 两溶液混合后
两溶液混合后![]() ,则一定有
,则一定有![]()
B.常温下,![]() 溶液与
溶液与![]() 溶液混合后所得
溶液混合后所得![]() 的溶液中:
的溶液中:![]()
C.![]() 溶液中离子总数为x,
溶液中离子总数为x,![]() 溶液中离子总数为y,则
溶液中离子总数为y,则![]()
D.已知:![]() 的
的![]() 为
为![]() ,若将浓度均为
,若将浓度均为![]() 的
的![]() 溶液和KOH溶液等体积混合,则会有
溶液和KOH溶液等体积混合,则会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳达到平衡:Ca(OH)2 (s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A.加水,Ca(OH)2 溶解平衡向右移动,pH 增大
B.加入少量盐酸,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
C.加入少量氢氧化钠固体,Ca(OH)2 溶解平衡向左移动,溶液中 c(H+)减小
D.升高温度,Ca(OH)2 溶解平衡向右移动,ksp﹝Ca(OH)2﹞增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再随时间变化时,表明反A(s)+2B(g)![]() C(g)+D(g)一定达到平衡状态的是
C(g)+D(g)一定达到平衡状态的是
A.混合气体的压强B.混合气体的密度
C.混合气体的物质的量D.混合气体中C和D的物质的量之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com