
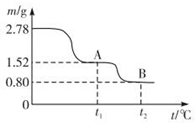
 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中锻烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.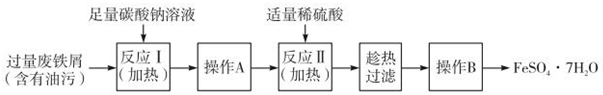
分析 (1)根据元素守恒,及绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈即能与氧化铁反应,可知绿矾油应为浓硫酸;2.78g的FeSO4•7H2O晶体的物质的量 $\frac{2.78g}{278g/mol}$=0.01mol,加热生成FeSO4时的质量为1.52g,再将FeSO4加热产生的所有气体通入足量的BaCl2溶液,得自色沉淀应为硫酸钡1.16g,即0.005mol,则说明产生三氧化硫为0.005mol,其质量为0.4g,得到铁的氧化物为0.8g,结合铁元素为0.01mol可知,该氧化物为Fe2O3,根据质量守恒可知,加热还产生二氧化硫的质量为1.52g-0.8g-0.4g=0.32g,即为0.005mol,据此答题;
(2)化学变化前后元素质量不变,2.88g草酸亚铁(FeC2O4)中铁元素的质量与1.44g铁的氧化物中铁元素的质量相等,由此可计算出铁的氧化物中铁与氧两元素的质量比,再由质量比计算出原子个数比而确定物质的化学式.
(3)①根据配制一定物质的是浓度溶液的操作所需仪器答题;
②分离固体和液体通常用过滤的方法,过滤所得固体表面有可溶性杂质,通过洗涤除去;
③酸性高锰酸钾溶液能将亚铁离子氧化成铁离子,根据电子得失守恒有5 FeSO4•7H2O~KMnO4,根据高锰酸钾的物质的量可计算得FeSO4•7H2O的质量,根据$\frac{硫酸亚铁晶体的质量}{样品的质量}$×100%计算质量分数.
解答 解:(1)根据元素守恒,及绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈即能与氧化铁反应,可知绿矾油应为浓硫酸;2.78g的FeSO4•7H2O晶体的物质的量 $\frac{2.78g}{278g/mol}$=0.01mol,加热生成FeSO4时的质量为1.52g,再将FeSO4加热产生的所有气体通入足量的BaCl2溶液,得自色沉淀应为硫酸钡1.16g,即0.005mol,则说明产生三氧化硫为0.005mol,其质量为0.4g,得到铁的氧化物为0.8g,结合铁元素为0.01mol可知,该氧化物为Fe2O3,根据质量守恒可知,加热还产生二氧化硫的质量为1.52g-0.8g-0.4g=0.32g,即为0.005mol,所以发生反应的化学方程式为2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2 ↑,
故答案为:浓硫酸;2FeSO4$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+SO3↑+SO2 ↑;
(2)2.88gFeC2O4中铁元素的质量=2.88g×$\frac{56}{56+12×2+16×4}$=1.12g,
铁的氧化物中铁与氧两元素的质量比=1.12g:(1.44g-1.12g)=56:16,
铁的氧化物中铁与氧两元素的原子个数比=$\frac{56g}{56g/mol}$:$\frac{16g}{16g/mol}$=1:1,则该铁的氧化物是FeO,
故答案为:FeO;
(3)①根据配制一定物质的是浓度溶液的操作所需仪器可知,用浓硫酸配制一定物质的量浓度的稀硫酸,所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及100mL容量瓶,
故答案为:100mL容量瓶;
②分离固体和液体通常用过滤的方法,过滤所得固体表面有可溶性杂质,通过洗涤除去,所以操作A为过滤、洗涤,
故答案为:过滤、洗涤;
③酸性高锰酸钾溶液能将亚铁离子氧化成铁离子,反应的离子方程式为5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,根据电子得失守恒有
5 FeSO4•7H2O~KMnO4,
5×278g 1mol
m(FeSO4•7H2O) 0.2000mol/L×0.02L
所以(FeSO4•7H2O)=0.2000mol/L×0.02L×278g=5.56g,所以样品中FeSO4•7H2O的质量分数为$\frac{5.56g}{6g}$×100%=93%,
故答案为:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O;93%.
点评 本题考查化学方程式的计算,侧重于学生的分析能力和计算能力的考查,为高频考点,注意把握物质的质量的变化关系,能读懂图象,从质量守恒的角度解答该题,难度较大.


科目:高中化学 来源: 题型:解答题
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO3与BaSO4沉淀 | B. | BaSO3沉淀 | ||
| C. | BaSO4沉淀 | D. | 无法得到沉淀物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6mol | B. | 5mol | C. | 4mol | D. | 2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HCl;Cu(OH)2+CH3COOH | B. | NaHSO4+NaOH;H2SO4+NaOH | ||
| C. | NaHCO3+H2SO4;Na2CO3+HCl | D. | BaCl2与Na2SO4;Ba(OH)2与CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
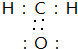
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
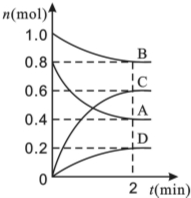 T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题:
T℃时,在容积为0.5L的密闭容器中发生某一反应,且测得不同时间容器中四种物质A、B、C、D的物质的量变化如图所示,已知:物质A、B、C均为气态,D为固态,正反应时吸热反应,根据要求回答下列问题:查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
用惰性电极电解物质的量浓度相同、体积比为3∶1的CuSO4溶液和NaCl溶液的混合溶液,不可能发生的反应是
A.2Cu2++2H2O 2Cu+4H++O2↑
2Cu+4H++O2↑
B.Cu2++2Cl- Cu+Cl2↑
Cu+Cl2↑
C.2Cl-+2H2O 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
D.2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com