
金刚烷是一种重要的化工原料,工业上可通过下列途径制备:

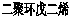
请回答下列问题:
(1)环戊二烯分子中最多有_____个原子共平面。 (2)金刚烷的分子式为________。
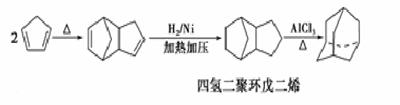
(3)下面是以环戊烷为原料制备环戊二烯的合成路线:

其中,反应②的反应试剂和反应条件是_______,反应③的反应类型是__________,反应④的化学方程式为 。
(4)已知烯烃能发生如下反应: 。请写出下列反应产物的结构简式:
。请写出下列反应产物的结构简式: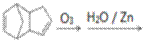 ____________________________。
____________________________。
(5)A是二聚环戊二烯的同分异构体,能使溴的四氯化碳溶液褪色,A经酸性高锰酸钾溶液加热氧化可以得到对苯二甲酸( ) 。若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):____________。
) 。若考虑苯环上的烯基侧链经酸性高锰酸钾溶液氧化得羧基,写出A所有可能的结构简式(不考虑立体异构):____________。
科目:高中化学 来源: 题型:
对达到平衡状态的可逆反应X+Y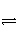
 Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则X、Y、Z、W 4种物质的聚集状态为( )
Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图所示,则X、Y、Z、W 4种物质的聚集状态为( )
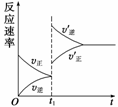
A.Z、W均为气体,X、Y中有一种是气体
B.Z、W中有一种是气体,X、Y皆非气体
C.X、Y、Z、W皆非气体
D.X、Y均为气体,Z、W中有一种为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
分析下图,回答以下问题:
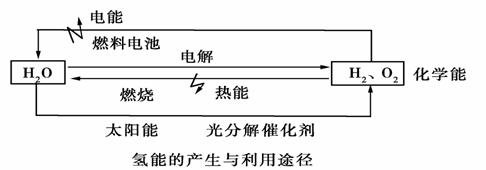
(1)水电解生成H2,首先要解决的问题是________________________________。
(2)氢气作为理想的“绿色能源”除了来源丰富,还有哪些优点:①________________________________,②________________________________。
(3)氢氧燃料电池是氢能源利用的一个重要方向,氢气在________极上发生________反应。若电解质溶液为KOH溶液,写出正负极上的电极反应:
正极________________________________,负极________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于煤、石油、天然气等资源的说法正确的是( )
A.石油裂解得到的汽油是纯净物
B.石油产品都可用于聚合反应
C.天然气是一种清洁的化石燃料
D.水煤气是通过煤的液化得到的气体燃料
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
A.14g乙烯和丁烯的混合物中含有的原子总数为3NA个
B.标准状况下,22.4L己烷中共价键数目为19NA
C.1mol苯乙烯(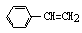 )中含有的C=C数为4NA
)中含有的C=C数为4NA
D.7g CnH2n中含有的氢原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关能量的叙述不正确的是
A.活化能的大小对化学反应前后的能量变化不产生影响
B.化学键的断裂和形成是物质在化学变化中发生能量变化的主要原因
C.盐酸和NaOH(aq)反应的中和热△H=-57.3kJ/mol,则H2SO4(aq)和Ca(OH)2(aq)反应的中和热△H=2×(-57.3)kJ/mol
D.CO(g)的燃烧热是283.0kJ/mol,则反应2CO2(g)=2CO(g)+O2(g)的反应热△H= +2 x283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装置如下图所示(夹持仪器已略去)。
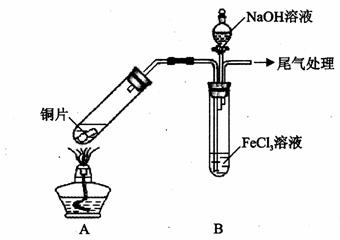
(1)实验前,应先检查装置的 ;实验中产生的尾气应通人 溶液。
(2)实验过程中需要配制100mL1mol/L FeCl3溶液(未用浓盐酸酸化),所需要的玻璃仪器有:烧杯、量筒、玻璃棒、 。
(3)该小组同学向5mL lmol/L FeCl3溶液中通人足量的SO2,溶液最终呈浅绿色,再打开分液漏斗活塞,逐滴加入NaOH稀溶液,则试管B中产生的实验现象是 。
(4)该小组同学在(3)中实验时,发现溶液变为浅绿色需要较长时间,在此期间同学们观察到的现象是溶液由棕黄色变成红棕色,没有观察到丁达尔现象,最终溶液呈浅绿色。
【查阅资料】Fe( HSO3)2+离子在溶液中呈红棕色且具有较强的还原性,能被Fe3+氧化为SO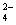 。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
。Fe(HSO3)2+与Fe3+在溶液中反应的离子方程式是 。
(5)为了探究如何缩短红棕色变为浅绿色的时间,该小组同学进行了如下实验:

向步骤①和步骤②所得溶液中加入某种试剂,溶液立即出现蓝色沉淀,则该试剂中含有溶质的化学式是 。
(6)综合上述实验探究过程,可以获得的实验结论:
I.SO2与FeCl3溶液反应生成红棕色中间产物Fe(HSO3)2+离子;
Ⅱ.红棕色中间产物转变成浅绿色溶液是一个较慢的过程;
Ⅲ. 。
查看答案和解析>>
科目:高中化学 来源: 题型:
垃圾处理的重要意义之一是控制环境污染,但在垃圾处理的过程中还要防止二次污染。下列处理垃圾的方法中有可能导致二次污染的是 ( )。
①卫生填埋 ②堆肥 ③焚烧
A.①② B.②③
C.①③ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com