
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 
【答案】
(1)432kJ/mol
(2)C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5KJ/mol
(3)46.1kJ
【解析】解:(1)反应热=反应物键能总和﹣生成物键能总和得到:436kJ/mol+243kJ/mol﹣2E(H﹣Cl)=﹣185kJ/mol,解得E(H﹣Cl)=432KJ/mol,
故答案为:432KJ/mol;(2)①2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1,
②C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1,
③2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
依据盖斯定律②+①﹣③得到C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol,
故答案为:C(s)+2CuO(s)═Cu2O(s)+CO(g)△H=+34.5KJ/mol;(3)图象分析可知,N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ﹣335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ;
故答案为:46.1kJ.
(1)反应热=反应物总键能﹣生成物总键能,据此计算;(2)依据热化学方程式和盖斯定律计算得到所需热化学方程式;(3)分析图象N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ﹣335KJ=92.2KJ,每生成1mol NH3放出热量46.1KJ.


科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
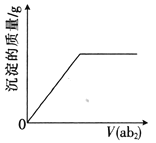
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )

A. 简单离子的半径:X<Z<M
B. 最高价氧化物对应水化物的酸性:R<N
C. Y、R两种元素的气态氢化物稳定性:Y>R
D. 由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,将3 mol A和1 mol B两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
xC(g)+2D(g)。2 min末该反应达到平衡,生成0.8 mol D,并测得C的浓度为0.2 mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为80%
C. 2 min内A的平均反应速率为0.3 mol·(L·min)-1
D. 若混合气体的密度不变则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. 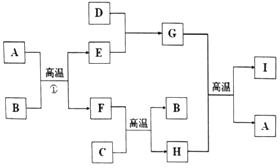
请回答下列问题:
(1)H的化学式为 .
(2)D 的电子式为 .
(3)K出反应①的化学方程式: .
(4)写出G的水溶液与C的硝酸盐溶液反应的方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应原理中,不符合工业冶炼金属实际情况的是
A.2HgO![]() 2Hg+O2↑ B.4Al+3MnO2
2Hg+O2↑ B.4Al+3MnO2![]() 2Al2O3+3Mn
2Al2O3+3Mn
C.2MgO![]() 2Mg+O2↑ D.4CO+Fe3O4
2Mg+O2↑ D.4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在炼锌厂和炼钢厂废弃的含锌烟道灰中,含有30%~50%的氧化锌,另含少量Fe2O3、CuO、SiO2、MnO等物质,可用该烟道灰为原料生产草酸锌晶体(ZnC2O4·2H2O)。

请回答下列问题:
(1)为了提高漫出速率,除将烟道灰处理得更细外,还可采取的措施有______ (写出一条)。
(2)证明除铁工序中Fe3+已经沉淀完全的实验步骤及现象是__________.
(3)上述流程中除铁与除铜的顺序不能颠倒,否则除铁率会减小,其原因是__________.
(4)己知: 常温下,Ksp[Fe(OH)3]=8.0×10-38.当加入ZnO控制反应液pH=5.0时,溶液中c(Fe3+)=_________.
(5)草酸能使酸性高锰酸钾溶液褪色,试写出相关反应的离子方程式:___________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com