
【题目】下列各组稀溶液,不用其他试剂无法鉴别的是
A.![]() 和NaOHB.
和NaOHB.![]() 和
和![]()
C.![]() 和
和![]() D.
D.![]() 和HCl
和HCl
【答案】C
【解析】
![]() 溶液中滴入NaOH立刻生成氢氧化铝白色沉淀,之后沉淀逐渐溶解,而向NaOH溶液中滴入
溶液中滴入NaOH立刻生成氢氧化铝白色沉淀,之后沉淀逐渐溶解,而向NaOH溶液中滴入![]() 溶液,开始没有明显现象,之后开始生成白色沉淀,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故A不选;
溶液,开始没有明显现象,之后开始生成白色沉淀,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故A不选;
B.![]() 溶液中滴入
溶液中滴入![]() ,开始时没有明显现象,之后会生成二氧化碳气体,而向
,开始时没有明显现象,之后会生成二氧化碳气体,而向![]() 中加入碳酸钠,立刻生成二氧化碳气体,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故B不选;
中加入碳酸钠,立刻生成二氧化碳气体,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故B不选;
C.![]() 和
和![]() 混合立刻生成碳酸钙沉淀,与滴加顺序无关,不用其他试剂无法鉴别,故C选;
混合立刻生成碳酸钙沉淀,与滴加顺序无关,不用其他试剂无法鉴别,故C选;
D.![]() 溶液中滴入HCl立刻生成白色沉淀,而HCl溶液中滴入
溶液中滴入HCl立刻生成白色沉淀,而HCl溶液中滴入![]() 溶液,开始时没有明显现象,HCl完全反应后再滴加
溶液,开始时没有明显现象,HCl完全反应后再滴加![]() 溶液会生成白色沉淀,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故D不选;
溶液会生成白色沉淀,二者滴加顺序不同反应现象不同,不用其他试剂即可鉴别,故D不选;
故选:C。


科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
2NO(g)+O2(g)在密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时,生成2n mol NO
③用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的平均相对分子质量不再改变的状态
A. ①④⑥B. ②③⑤C. ①③④D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意填空。
Ⅰ.常温下,某水溶液M中存在的离子有Na+、A2-、HA-、H+和OH-,存在的分子有H2O、H2A。根据题意回答下列问题:
(1)写出酸H2A的电离方程式:
________________________________________________________________________。
(2)实验测得NaHA溶液的pH>7,请分析NaHA溶液显碱性的原因:
________________________________________________________________________。
请写出NaHA溶液中离子浓度由大到小的顺序:
________________________________________________________________________。
Ⅱ.(1)如图甲表示用相同浓度的NaOH溶液分别滴定浓度相同的三种一元酸,由图可确定酸性最强的是________(填“①”“②”或“③”)。如图乙表示用相同浓度的AgNO3标准溶液分别滴定浓度相同的含Cl-、Br-及I-的混合溶液,由图可确定首先沉淀的离子是________。

(2)25 ℃时,Ksp(AgCl)=1.8×10-10。在1 L 0.1 mol·L-1 NaCl溶液中加入1 L 0.2 mol·L-1AgNO3溶液,充分反应后溶液中c(Cl-)=________ mol·L-1(假设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某pH =1的溶液X,其中可能含有Al3+、Fe2+、Fe3+、Ba2+、NH4+、CO32-、SO42-、SiO32-、NO3-中的一种或几种,取500 mL该溶液进行实验,其现象及转化如图所示。
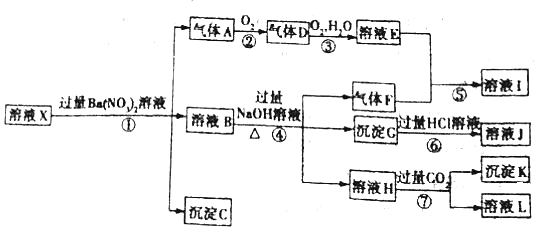
已知:反应过程中有一种气体是红棕色。请回答下列问题:
(1)仅由强酸性条件便可判断溶液X中一定不存在的离子有______。
(2)溶液X中,关于NO3-的判断一定正确的是______![]() 填字母
填字母![]() 。
。
a.一定有
b.一定没有
c.可能有
(3)反应①中产生气体A的离子方程式为______。
(4)反应⑦中生成沉淀K的离子方程式为______。
(5)溶液X中不能确定的离子是______。
(6)若实验测定A、F、K均为0.01 mol,试确定沉淀C是______,其物质的量范围是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,方案Ⅰ和方案Ⅱ均可行,且方案Ⅱ更合理的是
实验目的 | 方案Ⅰ | 方案Ⅱ | |
A | 除去乙酸乙酯中的少量乙酸 | 加饱和 | 蒸馏 |
B | 鉴别碳酸钠和碳酸氢钠溶液 | 分别滴加澄清石灰水 | 分别加热两溶液 |
C | 检验亚硫酸钠是否被氧化 | 滴入 | 滴入盐酸酸化的 |
D | 比较氯元素、碘元素的非金属性强弱 | 分别加热氯化氢、碘化氢,比较热稳定性 | 在淀粉碘化钾试纸上滴加氯水 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如下图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7。消耗NaOH溶液的体积为Vx、Vy则( )
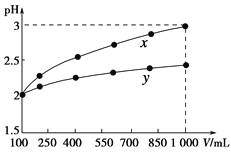
A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香草醛是一种食品添加剂,可由愈创木酚作原料合成,合成路线如下:
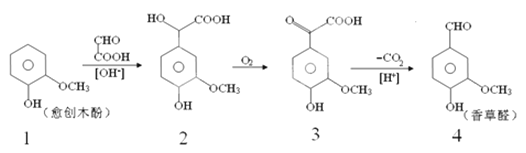
下列说法正确的是( )
A. 反应1→2属于加成反应,且生成的化合物2具有一个手性碳原子
B. 化合物2在一定条件下可发生消去反应
C. 检验制得的香草醛中是否混有化合物3,可用氯化铁溶液
D. 等物质的量四种化合物分别与足量NaOH反应,消耗NaOH物质的量之比为1:3:2:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】GaN是制造5G芯片的材料,氮化镓铝和氮化铝LED可发出紫外光。回答下列问题:
(1)基态As原子核外电子排布式为[Ar]____________;下列状态的铝元素中,电离最外层的一个电子所需能量最小的是______________(填标号)。
A.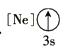 B.
B.![]() C.
C.![]() D.
D.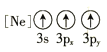
(2)8—羟基喹啉合铝(分子式C27H18AlN3O3)用于发光材料及电子传输材料,可由LiAlH4与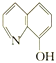 8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为______________; 8—羟基喹啉合铝中所含元素电负性最大的是______________(填元素符号,下同),第一电离能最大的是__________(填元素符号),N原子的杂化方式为_____________。
(3)已知下列化合物的熔点:
化合物 | AlF3 | GaF3 | AlCl3 |
熔点/℃ | 1040 | 1000 | 194 |
①表格中卤化物的熔点产生差异的原因是_______________________________________________。
②熔融AlCl3时可生成具有挥发性的二聚体Al2Cl6分子,分子中每个原子最外层均达到8电子,二聚体Al2Cl6的结构式为______________________________;其中Al的配位数为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com