
| ����\�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | O |
| 2 | E | |||||||
| 3 | A | C | D | G | ||||
| 4 | B | F |
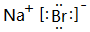 ���������ոû�����ʱ������ʻ�ɫ��
���������ոû�����ʱ������ʻ�ɫ������ ��Ԫ�������ڱ���λ�ã���֪AΪNa��BΪ�ء�CΪMg��DΪAl��EΪ����FΪBr��GΪAr��
��1��ϡ������ԭ�������Ϊ�ȶ��ṹ����ѧ��������ã�
��2��DԪ�ص�����������Ӧˮ����ΪAl��OH��3�����������Ʒ�Ӧ����ƫ��������ˮ��
��3��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����
��4��EԪ���⻯���ڳ����¸�B������Ӧ����ˮ��ط�Ӧ����KOH��������
��5��FԪ�ظ�AԪ���γɻ�����ΪNaBr�����������������ӹ��ɣ���Ԫ����ɫ��ӦΪ��ɫ��
��6��Mg��Al�ĵ������缫��ϡ�������������Һ������ԭ��أ�MgΪ������ʧȥ��������þ���ӣ�
��� �⣺��Ԫ�������ڱ���λ�ã���֪AΪNa��BΪ�ء�CΪMg��DΪAl��EΪ����FΪBr��GΪAr��
��1��ϡ������Arԭ�������Ϊ�ȶ��ṹ����ѧ��������ã��ʴ�Ϊ��Ar��
��2��DԪ�ص�����������Ӧˮ����ΪAl��OH��3�����������Ʒ�Ӧ����ƫ��������ˮ����ѧ��Ӧ�����ӷ���ʽΪ��Al��OH��3+OH-=AlO2-+2H2O���ʴ�Ϊ��Al��OH��3+OH-=AlO2-+2H2O��
��3��ͬ�����������ԭ�Ӱ뾶��С��ͬ�������϶���ԭ�Ӱ뾶����ԭ�Ӱ뾶��K��Na��Mg���ʴ�Ϊ��K��Na��Mg��
��4��EԪ���⻯���ڳ����¸�B������Ӧ����ˮ��ط�Ӧ����KOH��������ˮ�ĽṹʽΪH-O-H�����߷�Ӧ����ʽΪ��2K+2H2O=2KOH+H2�����ʴ�Ϊ��H-O-H��2K+2H2O=2KOH+H2����
��5��FԪ�ظ�AԪ���γɻ�����ΪNaBr�����������������ӹ��ɣ������ʽΪ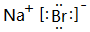 ��������Ԫ�أ��������ջ���Ϊ��ɫ���ʴ�Ϊ��
��������Ԫ�أ��������ջ���Ϊ��ɫ���ʴ�Ϊ��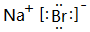 ���ƣ�
���ƣ�
��6��Mg��Al�ĵ������缫��ϡ�������������Һ������ԭ��أ�MgΪ������ʧȥ��������þ���ӣ��缫��ӦʽΪ��Mg-2e-=Mg2+���ʴ�Ϊ��Mg-2e-=Mg2+��
���� ���⿼��Ԫ�����ڱ���Ԫ�������ɡ����û�ѧ���ԭ��صȣ��ѶȲ����ضԻ���֪ʶ�Ĺ��̣�ע�����Ԫ�����ڱ��Ľṹ��


 ����ȫ���ִʾ��ƪ��ϵ�д�
����ȫ���ִʾ��ƪ��ϵ�д� �����߿����ϵ�д�
�����߿����ϵ�д� �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
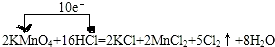 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

| ���� | �۵�/�� | �е�/�� | ���� |
| CCl4 | -23 | 76 | ��TiCl4���� |
| TiCl4 | -25 | 136 | ����ʪ������������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
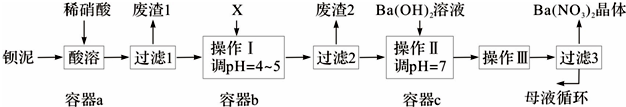
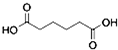 ��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ��ͼ��
��һ�ֹ�ҵ�Ͼ�����Ҫ������л���Ԫ�ᣬ�ڻ����������л��ϳɹ�ҵ��ҽҩ��������ȷ��涼����Ҫ���ã��ܹ��������η�Ӧ��������Ӧ�ȣ��������Ԫ�����۳ɸ߷��Ӿۺ���ȣ���������������ж�Ԫ�����еĵڶ�λ��ʵ���Һϳɼ�����ķ�Ӧԭ����ʵ��װ��ʾ��ͼ��ͼ��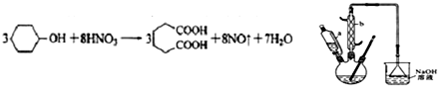
| ���� | �ܶȣ�20�棩 | �۵� | �е� | �ܽ��� | ��Է������� |
| ������ | 0.962g/cm3 | 25.9�� | 160.8�� | 20��ʱˮ���ܽ��3.6g���ɻ������Ҵ����� | 100 |
| �Ҷ��� | 1.36g/cm3 | 152�� | 337.5�� | ��ˮ�е��ܽ�ȣ�15��ʱ��1.44g��25��ʱ2.3g���������Ҵ��������ڱ� | 146 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������մ��������һ��ɼ���40%��50% | |
| B�� | �����������մ��������һ��ɼ���80%��90% | |
| C�� | ��Ϊ�Ƿ��ʽ���մ�������û�������ŷ� | |
| D�� | �����ĵ�Ҳ����Ⱦ���������������õ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��ʯī��s��=C�����ʯ��s����H=+1.9 kJ•mol-1�� | |
| B�� | C��ʯī��s��=C�����ʯ��s����H=-1.9 kJ•mol-1�� | |
| C�� | C��ʯī��s��=C�����ʯ��s����H=-788.92 kJ•mol-1�� | |
| D�� | C��ʯī��s��=C�����ʯ��s����H=+788.92 kJ•mol-1�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com