
 =0.1mol,含有0.1molNa+,0.1molHSO4-;所以阴阳离子的总数为0.2Na,故B正确;
=0.1mol,含有0.1molNa+,0.1molHSO4-;所以阴阳离子的总数为0.2Na,故B正确;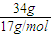 =2mol,1mol氨气分子中含有3molN-H键,所以2mol氨气分子中含有6molN-H键,故C错误;
=2mol,1mol氨气分子中含有3molN-H键,所以2mol氨气分子中含有6molN-H键,故C错误;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:浙江省金华一中2011-2012学年高一上学期期中考试化学试题(人教版) 题型:013
|
设NA为阿伏加德罗常数值,下列说法中正确的是 | |
| [ ] | |
A. |
氧化还原反应中,若消耗7.1 g Cl2,必转移0.2NA个电子 |
B. |
25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA |
C. |
NA个一氧化碳分子和0.5 mol甲烷(CH4)的质量比为7∶4 |
D. |
标准状况下,11.2 L氦气所含的原子数为NA |
查看答案和解析>>
科目:高中化学 来源:2011-2012年浙江省高一上学期期中考试化学试卷 题型:选择题
设NA为阿伏加德罗常数值,下列说法中正确的是
A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.NA个一氧化碳分子和0.5mol甲烷(CH4)的质量比为7︰4
D.标准状况下,11.2L氦气所含的原子数为NA
查看答案和解析>>
科目:高中化学 来源:2010年浙江省高一上学期期中考试化学卷 题型:选择题
设NA为阿伏加德罗常数值,下列说法中正确的是( )
A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子
B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.12g NaHSO4在熔融时离子总数为0.3NA
D.标准状况下,11.2L氦气所含的原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数值,下列说法中正确的是( )
A.氧化还原反应中,若消耗7.1g Cl2,必转移0.2NA个电子
B.将1.0molFeCl3全部制成胶体,其中氢氧化铁胶粒为NA个
C.12g NaHSO4在熔融时离子总数为0.3NA
D.标准状况下,11.2L氦气所含的原子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com