
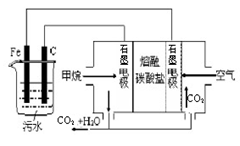
| A.铁电极为阳极,反应式为:Fe-3e-= Fe3+ |
| B.通入甲烷的石墨电极作负极,反应式为:CH4+8OH--8e-=CO2+6H2O |
| C.为增强污水的导电能力,可向污水中加入适量乙醇 |
| D.若阴极产生了44.8L气体,则理论上消耗同条件下的甲烷为11.2L |
科目:高中化学 来源:不详 题型:单选题

| A.若甲烧杯中盛有NaCl溶液,则石墨棒上的电极反应式为O2+2H2O+4e-= 4OH- |
| B.若乙烧杯中盛有则乙中的总反应为 |
| C.若甲烧杯中盛有CuSO4溶液,则甲中铁棒上的电极反应式为Fe-2e-=Fe2+ |
| D.若起始时乙中盛有200 mL pH=5的CuSO4溶液,一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入0.6 g CuO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ⑶生产普通玻璃和硅酸盐水泥所需用到的共同原料是 ,导电塑料可表示为
⑶生产普通玻璃和硅酸盐水泥所需用到的共同原料是 ,导电塑料可表示为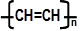 ,它属于 材料(填序号)
,它属于 材料(填序号)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2PbSO4(s) + 2H2O(l)
2PbSO4(s) + 2H2O(l)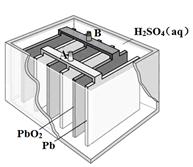
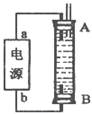
| A.放电时,正极反应为:PbO2(s) + 4H+(aq) + SO42-(aq) +2e- = PbSO4(s) + 2H2O(l) |
| B.充电时,应将外接直流电源的正极与铅蓄电池的接线柱A相接 |
| C.实验室用铅蓄电池做电源精炼粗铜时,应将粗铜与接线柱B相连接 |
| D.铅蓄电池做电源电解Na2SO4溶液时,当有2 mol O2产生时,消耗8 mol H2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

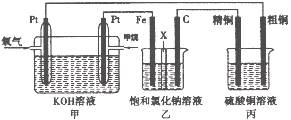
| A.图①连接好并放置片刻后,铁片会镀上一层铜 |
| B.图②连接好导线后(片与片相接触),电流表会发生明显偏转 |
| C.图③连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
| D.图④发生反应为Fe+2H+=Fe2++H2↑时,a、b可能是同种材料的电极 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
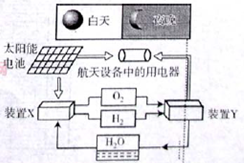
| A.该系统中只存在3种形式的能量转化 |
| B.装置Y中负极的电极反应式为:O2+2H2O+4e—=4OH— |
| C.装置X能实现燃料电池的燃料和氧化剂再生 |
| D.该系统能实现物质的零排放,并能实现化学能与电能间的完全转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列 问题。(不考虑氢、氧的氧化还原)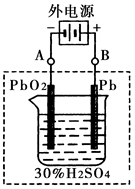
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com