
| A. | NO3-、BF3、N2O | B. | SO3、CO2、NO2 | C. | CO、N2、CN- | D. | CO2、SCN-、NO2+ |
分析 具有相同原子数和价电子数的微粒之间互称等电子体,等电子体往往具有相似的空间构型,抓住等电子体的特点进行分析、判断,即可解答.
解答 解:A.NO3-、BF3、N2O原子个数分别为4、4、3,不属于等电子体,故A错误;
B.SO3、CO2、NO2原子个数分别为4、3、3,不属于等电子体,故B错误;
C.CO、N2、CN-原子个数都为2;价电子数:前者碳为4,氧为6,共为10,中间氮为5,2个氮共为10,后者碳为4,氮为5,带一单位负电荷,共为10,原子数和价电子数都相等,属于等电子体,CO、N2、CN-空间构型都为直线型,故C正确;
D.CO2、SCN-、NO2+原子个数都为3;价电子数:前者碳为4,氧为6,共为16,中间硫为6、碳为4、氮为5,带一单位负电荷,共为16,后者氮为5,氧为6,带一单位正电荷,共为16,原子数和价电子数都相等,属于等电子体,CO2、SCN-、NO2+空间构型都为直线型,故D正确;
故选CD.
点评 本题考查了等电子体,解答本题关键是充分理解等电子体的本质特征,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该溶液的中水电离出的c(H+)=10-amol/L | |
| B. | 加水稀释,醋酸钠的水解程度增大,水的电离程度也增大 | |
| C. | 加入盐酸,pH=7时,有c(Cl-)=c(CH3COOH) | |
| D. | 向溶液中加入醋酸呈酸性,则一定是c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某溶液中加入足量稀硫酸,无明显现象,再加入AgNO3溶液,出现白色沉淀,则溶液中有Cl- | |
| B. | 向某溶液中滴加浓硫酸,将产生的气体通入品红溶液中,品红褪色,则溶液中一定有SO32- | |
| C. | 用洁净的铂丝蘸取某溶液在无色火焰上灼烧,透过蓝色钴玻璃观察火焰呈紫色,则溶液中有K+ | |
| D. | 在某溶液中,先加入足量BaCl2溶液,有白色沉淀生成;再加入足量稀盐酸,沉淀不溶解,则证明该溶液中含SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
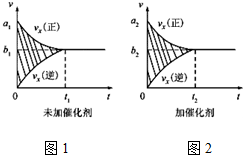
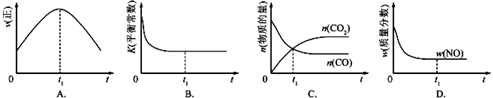
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
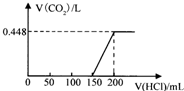 某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )
某混合溶液中含有NaOH与Na2CO3,向该溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸体积有如图关系(不考虑CO2在水中的溶解).则该混合溶液中NaOH与Na2CO3物质的量之比为( )| A. | 1:1 | B. | 2:1 | C. | 1:3 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性 | B. | 还原性 | C. | 酸性 | D. | 碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
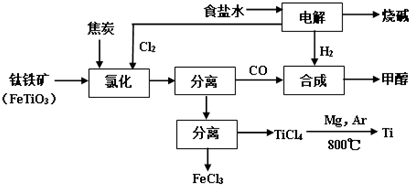
| 物质 | 沸点(℃) |
| TiCl4 | 136 |
| FeCl3 | 315 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com