
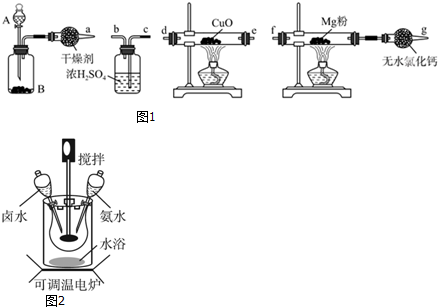
分析 (1)该实验的原理是将:浓氨水滴加到生石灰或氢氧化钠固体上,得到氨气,利用氨气的还原性,与氧化铜反应得到氮气,干燥的氮气与镁粉反应得到氮化镁;
①浓氨水滴入生石灰溶解放热,使一水合氨分解生成氨气;
②用装置B制备氨气,通过装置中氧化铜氧化氨气生成铜、氮气和水,生成气体通过浓硫酸干燥得到纯净干净的氮气进入装置和镁反应生成氮化镁,最后无水氯化钙是防止空气中水蒸气进入硬质玻璃管,氮化镁易与水反应;
③氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分为氮气,氨气被氧化铜氧化生成铜、氮气和水;
④氮化镁和水易发生反应生成氢氧化镁和氨气;
(2)此实验的原理是:按一定的固液比向三颈烧瓶中加入含镁复盐MgCO3(NH4)2CO3•H2O和蒸馏水,放在恒温水浴中加热,开启搅拌器同时加入氨水,待温度达到40℃时,滴加卤水(氯化镁溶液)并继续滴入氨水,待反应一段时间后,过滤洗涤干燥,得到碱式碳酸镁产品;
①反应需要的温度低于100°C,需要水浴加热,可以使反应物受热均匀;
②40℃复盐开始热解生成MgCO3•3H2O,根据元素守恒和部分生成物可写出化学方程式;此时开始滴加卤水的目的是吸收热解生成的氨气和二氧化碳;
③若碱式碳酸镁的质量mg(不考虑微量杂质),充分灼烧后,要确定其组成,需要测得剩余固体的质量,产生的二氧他碳气体体积能计算得到组成;
解答 解:(1)浓氨水滴加到生石灰或氢氧化钠固体上,得到氨气,利用氨气的还原性,与氧化铜反应得到氮气,干燥的氮气与镁粉反应得到氮化镁;
①浓氨水滴入生石灰或氢氧化钠固体溶解放热,使一水合氨分解生成氨气,
故答案为:生石灰或氢氧化钠;
②用装置B制备氨气,通过装置中氧化铜氧化氨气生成铜、氮气和水,生成气体通过浓硫酸干燥得到纯净干净的氮气进入装置和镁反应生成氮化镁,最后无水氯化钙是防止空气中水蒸气进入硬质玻璃管,氮化镁易与水反应,装置按照气流的方向连接装置顺序为:adecbf,
故答案为:decbf;
③氨气有还原性,能还原氧化铜,生成物之一是空气的主要成分为氮气,氨气被氧化铜氧化生成铜、氮气和水,反应的化学方程式为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu,
故答案为:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3H2O+3Cu;
④氮化镁和水易发生反应生成氢氧化镁和氨气,化学方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑;
(2)按一定的固液比向三颈烧瓶中加入该含镁复盐和蒸馏水,放在恒温水浴中加热,开启搅拌器同时加入氨水,待温度达到40℃时,滴加卤水(氯化镁溶液)并继续滴入氨水,待反应一段时间后,过滤洗涤干燥,得到碱式碳酸镁产品;
①选择水浴加热方式的优点是,可以使反应物受热均匀;
故答案为:使反应物受热均匀,温度容易控制;
②40℃复盐开始热解生成MgCO3•3H2O,根据元素守恒可知,复盐开始热解生成MgCO3•3H2O,并有气体产生,该气体应为二氧化碳和氨气,所以反应的化学方程式为MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑,此时开始滴加卤水的目的是吸收生成的氨气和二氧化碳,防止污染;
故答案为:MgCO3•(NH4)2CO3•H2O+H2O$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3•3H2O+2NH3↑+CO2↑;
吸收复盐热解生成的氨气和部分二氧化碳;
③已知制得的碱式碳酸镁可表示为xMgCO3•yMg(OH)2•H2O.若碱式碳酸镁的质量mg(不考虑微最杂质),充分灼烧后,要确定其组成,需要测得剩余固体的质量,产生的二氧他碳气体体积,故选bd;
故答案为:bd.
点评 本题考查了物质组成和含量的实验探究过程分析,物质性质、实验基本操作、化学方程式书写等知识,题目难度中等.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 改变的条件 | 结论 |
| A | 升温 | CO32-的水解平衡向右移动 |
| B | 加入AlCl3固体 | 产生大量气体 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均减小 |
| D | 加入少量CH3COONa固体 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
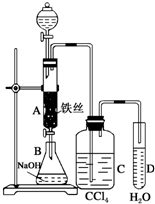 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com