
 ,SiF4的电子式为
,SiF4的电子式为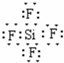 ,故答案为:
,故答案为: ;
; ;
; ,故答案为:
,故答案为: ;
;

 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
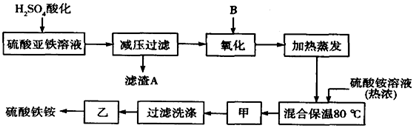
查看答案和解析>>
科目:高中化学 来源: 题型:
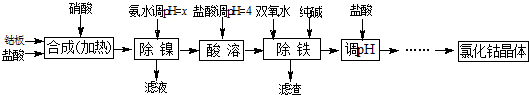
| 化学式 | 沉淀完全时的pH | 钴镍性质 |
| Co(OH)2 | 9.4 | Co+2HCl=CoCl2+H2↑ Co2++2NH3?H2O=Co(OH)2↓+2NH4+ Co2++2H2O?Co(OH)2+2H+ Ni+2HCl=NiCl2+H2↑ Ni2++6NH3?H2O=[Ni(NH3)6]2++6H2O |
| Fe(OH)2 | 9.6 | |
| Fe(OH)3 | 3.7 |
| 加NH3?H2O调pH | 收率/% | Ni2+含量/% |
| 9 | 98.1 | 0.08 |
| 9.5 | 98 | 0.05 |
| 10 | 97.6 | 0.005 |
| 10.3 | 94 | 0.005 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在同温同压下,相同体积的任何气体含有相同数目的原子 |
| B、氧化还原反应的判断依据是元素化合价是否有变化 |
| C、能导电的物质一定是电解质 |
| D、金属氧化物不一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯中含有少量苯酚,可用NaOH溶液除去 |
| B、NaOH固体中混有NH4HCO3,可直接加热除去NH4HCO3 |
| C、鉴别甲苯与己烯,可滴加酸性KMnO4溶液 |
| D、鉴别某溶液是否含有Fe2+,可先滴加新制氯水,再滴加KSCN溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧气 |
| 点燃 |
| 氧气 |
| 点燃 |
| 稀硫酸 |
| Mg |
| 点燃 |
| NH3、CO2 |
| △ |
| 氯气 |
| 点燃 |
| 氯气 |
| 点燃 |
| A、①④ | B、②③ | C、③ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
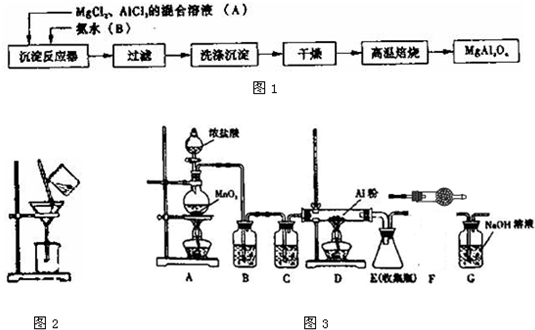
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com