
| 选项 | 实验 | 现象 | 结论 |
| A | 分别向2mL0.1mol/LNaHCO3,和2mL0.1mol/LNa2CO3溶液中滴加2mL 0.2mol/L的盐酸 | 盛有NaHCO3溶液试管产生气泡速度快 | 结合H+能力CO32->HCO3- |
| B | 将石蜡油(烷烃)蒸汽通过灼热的碎瓷片,并将产生的气体通人溴的四氯化碳溶液 | 溴的四氯化碳溶液褪色 | 生成气体中含有不饱和烃 |
| C | 向KI溶液中加入淀粉,然后滴入稀硫酸数滴 | 开始无明显现象,片刻溶液变蓝 | 氧化性:H2SO4>I2 |
| D | 向某溶液中加入盐酸 | 产生刺激性气味的气体和黄色沉淀 | 溶液中一定存在S2O32- |
| A. | A | B. | B | C. | C | D. | D |
分析 A.碳酸氢钠直接与盐酸反应生成二氧化碳气体,而碳酸钠与盐酸先生成碳酸氢钠,所以盛有NaHCO3溶液试管产生气泡速度快;
B.溴的四氯化碳溶液褪色,说明产物中含有不饱和烃;
C.酸性条件下碘离子更容易被氧化,与硫酸的氧化性无关;
D.硫化氢与二氧化硫反应生成S沉淀,原溶液可能为硫化钠、亚硫酸钠的混合液.
解答 解:A.分别向2mL0.1mol/LNaHCO3,和2mL0.1mol/LNa2CO3溶液中滴加2mL 0.2mol/L的盐酸,碳酸氢钠直接与盐酸反应生成二氧化碳气体,而碳酸钠与盐酸先生成碳酸氢钠,所以盛有NaHCO3溶液试管产生气泡速度快,与结合氢离子能力强弱无关,故A错误;
B.并将产生的气体通入溴的四氯化碳溶液,溴的四氯化碳溶液褪色,说明产物中含有不饱和键,则生成气体中含有不饱和烃,故B正确;
C.向KI溶液中加入淀粉,然后滴入稀硫酸数滴,酸性条件下碘离子更容易被氧气氧化,该现象无法判断H2SO4、I2的氧化性强弱,故C错误;
D.向某溶液中加入盐酸,产生刺激性气味的气体和黄色沉淀,产物为二氧化硫和S单质,原溶液中可能含有硫化钠、亚硫酸钠,溶液中不一定存在S2O32-,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度中等,涉及氧化还原反应、离子检验、有机物结构与性质等知识,明确常见元素及其化合物性质为解答关键,试题培养了学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
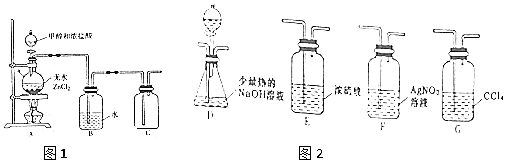
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
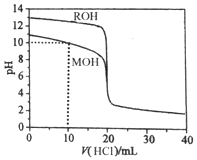
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
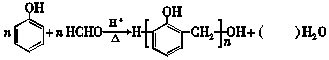
| A. | 方程式中水的化学计量数是 2n-1 | |
| B. | 常温下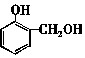 比 比 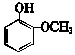 更难溶于水 更难溶于水 | |
| C. | 1 mol HCHO与银氨溶液反应最多可以生成2 mol Ag | |
| D. |  的单体是 的单体是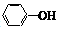 和HCHO 和HCHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
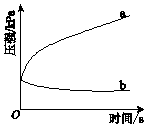 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含NA个Na+的NaOH溶于1L水中形成溶液的物质的量浓度为lmol•L-1 | |
| B. | 总质量为18g的H216O和H218O所含分子数为NA | |
| C. | 常温常压下,22.4L的CO2与Mg完全反应,转移电子数为4NA | |
| D. | 硫酸的摩尔质量与NA个硫酸分子的质量在数值上相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 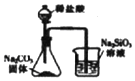 如图用于证明非金属性强弱:Cl>C>S | |
| B. |  如图用于分离I2和NH4Cl | |
| C. |  如图用于测定某NaOH溶液的浓度 | |
| D. | 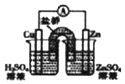 如装置能组成Cu-Zn原电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
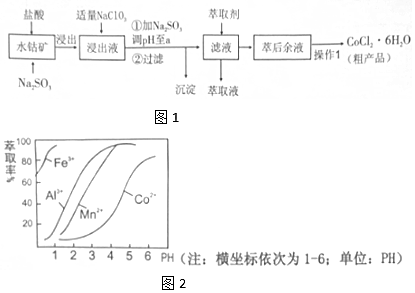
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com