
分析 根据题目信息可知,铁和铝与稀盐酸生成氢气,铝和硅与氢氧化钠生成氢气;铝和盐酸、氢氧化钠溶液反应的方程式为:2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等;则铁和盐酸生成的氢气的量等于硅和氢氧化钠生成的氢气的量,据此列式进行计算.
解答 解:根据题目信息可知,铁和铝与稀盐酸生成氢气,铝和硅与氢氧化钠生成氢气.铝和盐酸、NaOH溶液反应的反应方程式为:2Al+6HCl=2AlCl3+3H2↑,2Al+2NaOH+2H2O=2NaAlO2+3H2↑,说明相同质量的铝与盐酸或者氢氧化钠生成氢气的质量相等,
则铁和盐酸生成的氢气与硅和氢氧化钠生成的氢气相等,
设铁与盐酸生成的氢气的物质的量为n,硅的物质的量为x,铁的物质的量为y,
Si+2NaOH+H2O═Na2SiO3+2H2↑
1 2
x n
则:n=2x,
Fe+2HCl=FeCl2+H2↑,
1 1
y n
则:y=n,
生成的氢气相等,则:n=2x=y,
整理可得:x:y=1:2,
答:混合物中铁和硅的物质的量比1:2.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的实质为解答关键,注意等量的铝与盐酸、氢氧化钠溶液反应时生成的氢气的量相等,试题培养了学生的化学计算能力.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液呈中性的盐一定是强酸、强碱生成的盐 | |
| B. | 含有弱酸根盐的水溶液一定呈碱性 | |
| C. | 盐溶液的酸碱性主要决定于形成盐的酸和碱的相对强弱 | |
| D. | 强酸强碱盐的水溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60% | B. | 40% | C. | 33.3% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
| 完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
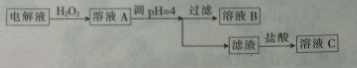
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质溶液导电的原因是靠自由移动的阴、阳离子 | |
| B. | 电解质在水溶液中不一定完全电离 | |
| C. | 纯净的电解质在液态时,有的导电,有的不导电 | |
| D. | 无水CuSO4不导电,但胆矾中含结晶水,所以胆矾可以导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 HCN+OH-
HCN+OH-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com