
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA
B.常温下,5.6gFe与含0.2molHNO3的溶液充分作用,最少失去的电子数为0.15NA
C.2.0gD2O中含有的质子数、电子数均为NA
D.含1molCl+的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH![]() 数为NA
数为NA
【答案】B
【解析】
A.乙烯和环丁烷的最简式都为CH2,则28g乙烯和环丁烷的混合气体中含有的碳原子数为2NA,故A正确;
B.如果硝酸是浓硝酸,则铁在常温下在浓硝酸中钝化,失去的电子数几乎为零,故B错误;
C.依据2gD2O的物质的量=![]() =0.1mol,故所含有的质子数为0.1mol×10=1mol,即NA个、含有的电子数为0.1mol×10=1mol,即NA个,故C正确;
=0.1mol,故所含有的质子数为0.1mol×10=1mol,即NA个、含有的电子数为0.1mol×10=1mol,即NA个,故C正确;
D.加入一定量的氨水后,溶液呈中性,n(H+)=n(OH-),据溶液中的电荷守恒:n(Cl-)+n(OH-)=n(NH4+)+n(H+),所以n(NH4+)=n(Cl-)=1mol,故此时溶液中NH4+数为NA,故D正确。
答案选B。


科目:高中化学 来源: 题型:
【题目】NH3水溶液呈弱碱性,并可用作农业化肥,现进行下列研究:现将一定量的H2和N2充入10L的密闭容器中,在一定条件下使其发生反应,有关H2、N2、NH3三者的物质的量的变化与时间的关系如图所示:
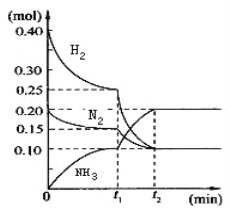
(1)若t1=10min,则0至t1时间内H2的反应速率为_________;
(2)下列几种情形中可以证明合成氨的反应N2(g)+3H2(g)![]() 2NH3(g)已达平衡状态的是_____。
2NH3(g)已达平衡状态的是_____。
①单位时间内生成nmolN2的同时生成2nmolNH3;
②1个N≡N键断裂的同时,有6个N—H键形成;
③1个N≡N键断裂的同时,有3个H—H键形成;
④混合气体的压强不再改变的状态;
⑤混合气体的密度不再改变的状态;
⑥混合气体的平均相对分子质量不再改变的状态。
(3)根据图中曲线变化情况判断,t1时刻改变的反应条件可能是_____(填字母)
a.加入了催化剂 b.降低了反应的温度 c.缩小容器体积增大压强
(4)t2时刻后反应达平衡,N2总共的转化率为______。
(5)在t1时刻对应的反应条件下,该反应的平衡常数是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molH2(g)与1molI2(g)反应生成HI(g)释放出8.7kJ热量,有关数据如图所示:
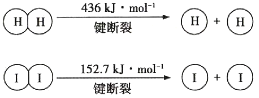
下列说法不正确的是( )
A.H2和I2的总能量低于HI的能量
B.破坏1molH—I键需要的能量是298.7kJ
C.1molHI(g)完全分解生成H2(g)和I2(g)时吸收4.35kJ热量
D.H2(g)中的H—H键比HI(g)中的H—I键牢固
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:

(1)写出得到单质铁的化学方程式:_________________________。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:______。
(3)装置末端气球的作用为_____________________________。实验结束时,应该先停止加热还是先停止通入CO?原因是什么?_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
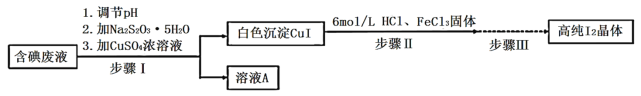
【题目】碘可利用的资源有限,因此碘的工业回收有重要意义。如图是某研究小组设计的从实验室含碘废液(主要含有![]() 、
、![]() 和淀粉等)中回收获得高纯碘晶体的流程。
和淀粉等)中回收获得高纯碘晶体的流程。
已知:![]() ,
,![]() ,实验条件下
,实验条件下![]() 不与
不与![]() 发生氧化还原反应。回答下列问题:
发生氧化还原反应。回答下列问题:
(1)步骤I中,在装有含碘废液的烧杯中,先加入![]() 固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
固体,在搅拌下溶解后,再慢慢加入硫酸铜溶液,硫酸铜的作用是________。
(2)下列有关步骤I的说法正确的是_________________。
A.实验中应调节![]() 为强酸性环境
为强酸性环境
B.![]() 溶液不能先于
溶液不能先于![]() 晶体加入,是为了防止生成的碘挥发而损失
晶体加入,是为了防止生成的碘挥发而损失
C.加入硫代硫酸钠的量应控制至含碘废液的蓝色刚好褪去
D.溶液![]() 中含硫元素的离子可能有
中含硫元素的离子可能有![]() 、
、![]() 、
、![]() 等
等
(3)步骤Ⅱ为反应生成碘并蒸馏出碘的过程,示意图如图所示:
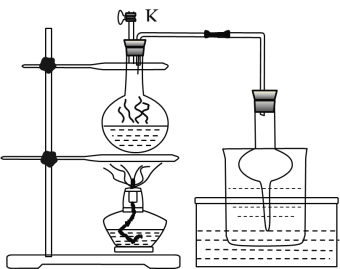
①写出步骤Ⅱ的离子方程式________。
②步骤Ⅱ,检查装置气密性(此时![]() 关闭),在圆底烧瓶中加入
关闭),在圆底烧瓶中加入![]() 和
和![]() 固体及适量
固体及适量![]() ,其后续的操作顺序是________。(选择合理操作,并排序)
,其后续的操作顺序是________。(选择合理操作,并排序)
a.打开![]() b.关闭
b.关闭![]() c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
c. 用酒精灯加热 d. 停止加热 e. 观察到圆底烧瓶中溶液紫色消失
③实验后期,发现玻璃管中少量碘晶体凝结,其处理的简易操作方法________;
(4)步骤Ⅲ中,主要涉及的操作依次是抽滤、洗涤、干燥和________。其中,抽滤、洗涤沉淀后的滤纸不能丢弃,应保留到后续操作中,其原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应广泛应用于金属的冶炼。下列说法不正确的是
A. 电解熔融NaCl制取金属钠的反应中,钠离子被还原,氯离子被氧化
B. 湿法炼铜与火法炼铜的反应中,铜元素都发生还原反应
C. 用磁铁矿炼铁的反应中,1 mol Fe3O4被CO还原成Fe,转移9 mol e
D. 铝热法还原铁的反应中,放出的热量能使铁熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
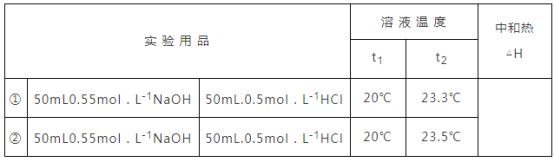
【题目】某化学兴趣小组要完成中和热的测定.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、![]() 盐酸、
盐酸、![]() 溶液,尚缺少的实验玻璃用品是____、___.
溶液,尚缺少的实验玻璃用品是____、___.
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒?_____(填“能”或“否”),其原因是____.
(3)实验中![]() 的浓度比
的浓度比![]() 的大,其原因是________
的大,其原因是________
(4)若用![]() 代替
代替![]() ,对测定结果________(填“有”或“无”)影响;若用醋酸代替
,对测定结果________(填“有”或“无”)影响;若用醋酸代替![]() 做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
做实验,则测定结果________(填“偏高”“偏低”或“无影响”).
(5)他们记录的实验数据如下:已知:![]() ,反应后溶液的比热容
,反应后溶液的比热容![]() 为
为![]() ,各物质的密度均为
,各物质的密度均为![]() .计算完成下表_______
.计算完成下表_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图所示裝置制备氯气并进行性质实验(必要时可加热,省略夹持装置)
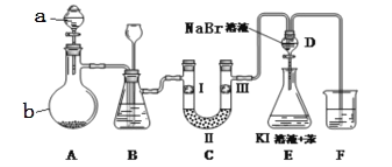
(1)仪器a的名称是:_______;装置B中长颈漏斗的作用是:_______。蒸馏烧瓶b中发生反应的化学方程式为________。
(2)洗气装置B试剂是饱和食盐水,其作用是______,分液漏斗D中发生反应的化学方程式为________。
(3)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式_______。
(4)设计实验比较氯、溴的氧化性强弱。操作和现象和结论为:取适量溴化钠溶液和苯混合于试管中,通入_______,振荡静置,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)据中新社2017年6月29日电,也门遭世界最严重霍乱疫情 1400人死亡疑20余万人感染。霍乱是由霍乱弧菌引起的急性肠道传染病,患者常出现呕吐、腹泻、脱水和高烧等症状,重症和延误治疗可致死亡。据联合国儿童基金会专家表示,正常情况下,霍乱可以预防并且治愈率很高,但由于也门基础设施被完全损坏,将很难控制疾病传播。
请根据此信息和题意回答下列问题(填字母,下同)。
a.蛋白质 b.氨基酸 c.葡萄糖 d.变性 e.盐析
①霍乱弧菌中的主要成分中含有____________;该成分经水解后变为__________;
②为了预防霍乱,该疫情地区普遍采用喷洒消毒水进行消毒,对所接触到的器具均采用高温灭菌处理,这是因为在高温条件下病毒和细菌都发生了__________。
(2)化学与材料密切相关,材料是人类生存和发展的物质基础。
①在快中子反应堆中得以广泛应用的钠钾合金在常温下呈液态,这个事实说明合金的熔点比其成分金属的熔点_______(填“高”或者“低”)。
②有机玻璃(聚甲基丙烯酸甲酯)实际上不是硅酸盐材料而是一种线型高分子化合物,它具有_____________性(选填“热塑”或“热固”)。
③据报道,每年我国因金属腐蚀造成的损失占国民生产总值(GDP)的4%。钢铁在潮湿的空气中发生________腐蚀时,负极的电极反应为 ______________。
(3)化学与环境紧密联系。
①空气质量报告的各项指标可以反映出各地空气的质量。下列物质不属于空气污染物的是______(填字母)
a.SO2 b.NO2 c.PM2.5 d.CO2
② 天然水中杂质较多,常需加入明矾,ClO2等物质处理后才能饮用。加入ClO2的作用是__________________;加入明矾后, Al3+水解的离子方程式是 ________________。
③为减少SO2的排放量,可向煤中加入适量 __________(填名称);也可以将煤气化,即在高温条件下与水蒸气反应转化为水煤气,该反应方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com