

·ÖĪö £Ø1£©»ī»ÆÄÜŅ»ÖÖĪļÖŹ·Ö×ÓÓÉĘÕĶØ·Ö×Ó½ų»ÆĪŖ»ī»Æ·Ö×ÓĖłŠčÄÜĮ棻øł¾Ż·“Ó¦ĪļÓėÉś³ÉĪļµÄ×ÜÄÜĮæĄ“·ÖĪöCH3OH£Øg£©ØTHCHO£Øg£©+H2£Øg£©µÄČČ·“Ó¦£»
£Ø2£©¹ż³Ģ¢ņÓė¹ż³Ģ¢ń±Č½Ļ»ī»ÆÄܼõŠ”£¬ĖłŅŌøıäµÄĢõ¼žŹĒ¼ÓČėĮĖ“߻ƼĮ£»
£Ø3£©“߻ƼĮÄܽµµĶ·“Ó¦µÄ»ī»ÆÄÜ£¬µ«ĪĀ¶Č¶Ō»ī»ÆÄÜĪŽÓ°Ļģ£»ĪĀ¶ČÄÜĢįøß»Æѧ·“Ó¦ĖŁĀŹ£¬¶Ō·“Ó¦ČČĪŽÓ°Ļģ£®
½ā“š ½ā£ŗ£Ø1£©»ī»ÆÄÜŅ»ÖÖĪļÖŹ·Ö×ÓÓÉĘÕĶØ·Ö×Ó½ų»ÆĪŖ»ī»Æ·Ö×ÓĖłŠčÄÜĮ棬ÓÉĶ¼æÉÖŖCH3OH£Øg£©ØTHCHO£Øg£©+H2£Øg£©µÄ»ī»ÆÄÜĪŖ2050kJ/mol£»CH3OH£Øg£©ØTHCHO£Øg£©+H2£Øg£©·“Ó¦ĪļµÄ×ÜÄÜĮæĪŖ2050kJ£¬Éś³ÉĪļµÄ×ÜÄÜĮæĪŖ2053kJ£¬ŌņøĆ·“Ó¦ĪŖ·ÅČČ·“Ó¦£¬·Å³öµÄČČĮæĪŖ2050kJ-2053kJ=-3kJ£¬¹Ź·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ĪŖCH3OH£Øg£©ØTHCHO£Øg£©+H2£Øg£©”÷H=-3kJ/mol£¬
¹Ź“š°øĪŖ£ŗ2050£»-3kJ/mol£»
£Ø2£©¹ż³Ģ¢ņÓė¹ż³Ģ¢ń±Č½Ļ»ī»ÆÄܼõŠ”£¬ĖłŅŌøıäµÄĢõ¼žŹĒ¼ÓČėĮĖ“߻ƼĮ£¬¹ŹĶ¼ÖŠĒśĻߢņ±ķŹ¾Ź¹ÓĆĮĖ“߻ƼĮ£¬
¹Ź“š°øĪŖ£ŗ¢ņ£»
£Ø3£©“߻ƼĮÄܽµµĶ·“Ó¦µÄ»ī»ÆÄÜ£¬µ«ĪĀ¶Č¶Ō»ī»ÆÄÜĪŽÓ°Ļģ£¬¹ŹĒśĻߢńÖŠ·“Ó¦µÄ»ī»ÆÄܲ»±ä£»ĪĀ¶ČÄÜĢįøß»Æѧ·“Ó¦ĖŁĀŹ£¬¶Ō·“Ó¦ČČĪŽÓ°Ļģ£¬¹Ź·“Ó¦µÄ·“Ó¦ČČ”÷H²»±ä£»
¹Ź“š°øĪŖ£ŗ²»±ä£»²»±ä£®
µćĘĄ ±¾Ģā漲鷓ӦČČÓėģŹ±ä£¬×¢Ņā·“Ó¦ĪļÓėÉś³ÉĪļ×ÜÄÜĮæÓė·“Ó¦ČČµÄ¹ŲĻµ£¬ĢŲ±šŹĒ“߻ƼĮÖ»øı䷓ӦµÄ»ī»ÆÄÜ£¬µ«²»ÄÜøı䷓ӦČČ£¬ĢāÄæÄŃ¶Č²»“ó£®


 æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø
æŖŠÄæģĄÖ¼ŁĘŚ×÷ŅµŹī¼Ł×÷ŅµĪ÷°²³ö°ęÉēĻµĮŠ“š°ø ĆūĢāѵĮ·ĻµĮŠ“š°ø
ĆūĢāѵĮ·ĻµĮŠ“š°ø ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
ĘŚÄ©¼Æ½įŗÅĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ź÷ĮÖ³æźŲÖŠ¼ūµ½µÄĀĘĀĘŃō¹ā£¬ŹĒ¶”“ļ¶ūŠ§Ó¦Š§Ó¦Ōģ³ÉµÄ | |
| B£® | Ęū³µĪ²ĘųĪŪČ¾ĪļÖŠŗ¬ÓŠµŖµÄŃõ»ÆĪļ£¬ŹĒĘūÓĶ²»ĶźČ«Č¼ÉÕŌģ³ÉµÄ | |
| C£® | ÉńÖŪ11ŗÅ·É“¬ĖłÓĆĢ«ŃōÄܵē³Ų°åæɽ«¹āÄÜ×Ŗ»»ĪŖµēÄÜ£¬ĖłÓĆ×Ŗ»»²ÄĮĻŹĒ¶žŃõ»Æ¹č | |
| D£® | ¾”ĮæŹ¹ÓĆŗ¬12CµÄ²śĘ·£¬¼õÉŁŹ¹ÓĆŗ¬13C»ņ14CµÄ²śĘ··ūŗĻ”°“Ł½ųµĶĢ¼¾¼Ć”±×ŚÖ¼ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ėłŗ¬¹²¼Ū¼üŹż¾łĪŖ0.4NAµÄ°×Į×£ØP4£©ŗĶ¼×ĶéµÄĪļÖŹµÄĮæĻąµČ | |
| B£® | 10gÅضČĪŖ46%µÄŅŅ“¼Ė®ČÜŅŗÖŠŗ¬ÓŠµÄĒāŌ×Ó×ÜŹżĪŖ1.2NA | |
| C£® | 2 g H2·Ö±šÓė×ćĮæµÄC12ŗĶN2³ä·Ö·“Ó¦ŗó×ŖŅʵĵē×ÓŹż¾łĪŖ2NA | |
| D£® | 1molFe£ØOH£©3Óėŗ¬3molHIµÄČÜŅŗĶźČ«·“Ó¦ŗó£¬ČÜŅŗÖŠĖłŗ¬I-µÄŹżÄæĪŖ3NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
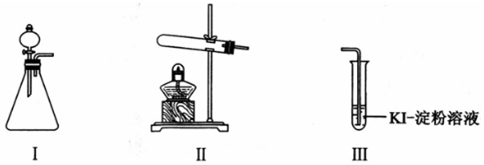
| ²Ł×÷ | ĻÖĻó | |
| ¼× | ĻņIµÄ׶ŠĪĘæÖŠ¼ÓČėMnO2¹ĢĢ壬£®ĻņIµÄ·ÖŅŗĀ©¶·ÖŠ¼ÓČė30% H2O2ČÜŅŗ£¬Į¬½ÓI”¢¢ó£¬“ņæŖ»īČū | IÖŠ²śÉśĪŽÉ«ĘųĢå²¢°éĖę“óĮæ°×Īķ£»¢óÖŠÓŠĘųÅŻĆ°³ö£¬ČÜŅŗŃøĖŁ±äĄ¶ |
| ŅŅ | Ļņ¢ņÖŠ¼ÓČėKMnO4¹ĢĢ壬Į¬½Ó¢ņ”¢¢ó£¬µćČ¼¾Ę¾«µĘ | ¢óÖŠÓŠĘųÅŻĆ°³ö£¬ČÜŅŗ²»±äĄ¶ |
| ±ū | Ļņ¢ņÖŠ¼ÓČėKMnO4¹ĢĢ壬¢óÖŠ¼ÓČėŹŹĮæ0.1mol/L H2SO4ČÜŅŗ£¬Į¬½Ó¢ņ”¢¢ó£¬µćČ¼¾Ę¾«µĘ | ¢óÖŠÓŠĘųÅŻĆ°³ö£¬ČÜŅŗ±äĄ¶ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | pH=1µÄĮņĖįČÜŅŗÖŠŗ¬ÓŠµÄSO42-ŹżÄæĪŖ0.05NA | |
| B£® | 100gÖŹĮæ·ÖŹżĪŖ46%µÄŅŅ“¼ČÜŅŗÖŠĖłŗ¬µÄĒāŌ×ÓŹżĪŖ12NA | |
| C£® | 100mL 1mol/L CH3COONa ČÜŅŗÖŠŗ¬ÓŠµÄCH3COO-ŹżÄæĪŖ0.1NA | |
| D£® | 0.2molNH3Óė0.3molO2ŌŚ“߻ƼĮµÄ×÷ÓĆĻĀ¼ÓČČ³ä·Ö·“Ó¦£¬ĖłµĆNOµÄ·Ö×ÓŹżĪŖ0.2NA |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ĪĀ¶Č/”ę | 1 000 | 1 150 | 1 300 |
| Ę½ŗā³£Źż | 4.0 | 3.7 | 3.5 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 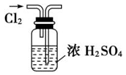 øÉŌļCl2 øÉŌļCl2 | B£® |  ĪüŹÕHCl | C£® | 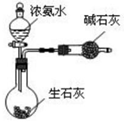 ÖʱøøÉŌļµÄ°±Ęų | D£® | 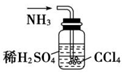 ĪüŹÕNH3 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com