
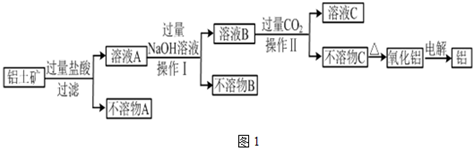
分析 铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)中加入足量稀盐酸,发生的反应为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2和稀盐酸不反应,然后过滤,所以滤液A中溶质为FeCl3、AlCl3、HCl,不溶物A为SiO2;向A溶液中加入过量NaOH溶液,发生的离子反应为Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,然后过滤,滤液B中含有NaAlO2和NaOH,不溶物B为Fe(OH)3,向滤液B中通过过量二氧化碳,发生的离子反应方程式为OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;然后过滤,得到的溶液C中溶质为NaHCO3,不溶物C是Al(OH)3,加热Al(OH)3,发生的反应为
2Al(OH)3$\frac{\underline{\;加热\;}}{\;}$Al2O3+3H2O,电解熔融氧化铝得到Al;
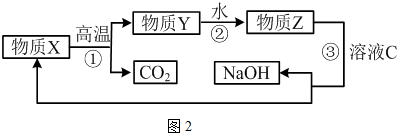
(5)碳酸钙高温下分解生成CaO和CO2,CaO和H2O反应生成Ca(OH)2,Ca(OH)2和NaHCO3反应生成CaCO3和NaOH,所以X是CaCO3、Y是CaO、Z是Ca(OH)2;
(6)在涉及到食物包装及其含有铝元素的药品时要注意尽可能的避免,据此分析解答.
解答 解:铝土矿(主要成分为Al2O3,另含有Fe2O3和SiO2)中加入足量稀盐酸,发生的反应为Al2O3+6H+=2Al3++3H2O、Fe2O3+6H+=2Fe3++3H2O,SiO2和稀盐酸不反应,然后过滤,所以滤液A中溶质为FeCl3、AlCl3、HCl,不溶物A为SiO2; 向A溶液中加入过量NaOH溶液,发生的离子反应为Fe3++3OH-=Fe(OH)3↓、Al3++4OH-=AlO2-+2H2O,然后过滤,滤液B中含有NaAlO2和NaOH,不溶物B为Fe(OH)3,向滤液B中通过过量二氧化碳,发生的离子反应方程式为OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;然后过滤,得到的溶液C中溶质为NaHCO3,不溶物C是Al(OH)3,加热Al(OH)3,发生的反应为
2Al(OH)3$\frac{\underline{\;加热\;}}{\;}$Al2O3+3H2O,电解熔融氧化铝得到Al,
(1)实验室里过滤用到的玻璃仪器有烧杯、玻璃棒和漏斗,故答案为:玻璃棒、漏斗;
(2)操作Ⅱ中生成不溶物C的离子方程式是OH-+CO2=HCO3-、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:OH-+CO2=HCO3-;AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
3)氧化铝的熔点高达205℃,工业上为降低能耗,在铝的电解冶炼时,采取的措施是加入冰晶石降低氧化铝熔点,
故答案为:加入冰晶石降低氧化铝熔点;
(4)电解冶炼铝时,阳极和阴极以碳素材料制成,电解过程中,阳极材料需定期进行更换,原因是
阳极上生成的氧气和C反应生成二氧化碳,导致阳极材料减少,所以需要定期进行更换,
故答案为:阳极上生成的氧气和C反应生成二氧化碳;
(5)碳酸钙高温下分解生成CaO和CO2,CaO和H2O反应生成Ca(OH)2,Ca(OH)2和NaHCO3反应生成CaCO3和NaOH,所以X是CaCO3、Y是CaO、Z是Ca(OH)2,
①上述转化中,①②③分别是分解反应、化合反应、复分解反应,所以没有涉及四个基本反应类型中的置换反应,
故答案为:置换;
②过程③的化学方程式:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O,
故答案为:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O;
(6)科学研究表明,人体过量吸入铝元素会严重危害身体健康,杜绝铝元素过量吸入的措施:不用铝制品炊具或不用铝箔包装食品,
故答案为:不用铝制品炊具或不用铝箔包装食品.
点评 本题以铝及其化合物为载体考查物质分离和提纯,综合性较强,涉及离子方程式的书写、物质推断、金属冶炼、基本操作等知识点,明确基本操作规则及仪器用途、离子方程式书写规则、电解原理等知识点即可解答,注意:铝应该采用电解熔融氧化铝方法冶炼,不能采用电解熔融氯化铝冶炼,为易错点.


 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 1和6 | B. | 2和6 | C. | 1和7 | D. | 2和7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②:
②:
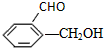 ④
④ ⑤
⑤
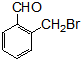 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 闻名世界的中国陶瓷、酿酒、造纸技术都充分应用了化学工艺 | |
| B. | 黑火药是我国古代四大发明之一,配方为“一硫二硝三木炭”,其中的硝是指硝酸 | |
| C. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| D. | 黑色金属材料通常包括铁、铬、锰以及它们的合金,是应用非常广泛的金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图1装置用于证明氯的非金属性比硅强 | |
| B. | 图2装置用于实验室收集NO2气体 | |
| C. | 图3装置用于验证NH3极易溶于水 | |
| D. | 图4装置用于实验室制备气体Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
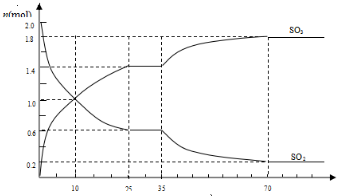
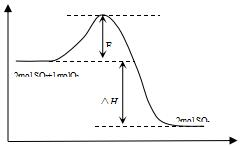 2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.
2SO2(g)+O2(g)?2SO3(g)△H<0,是工业制硫酸的主要反应之一.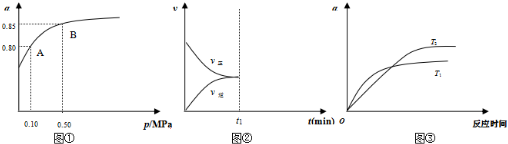
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验含碘盐中的碘元素 | |
| B. | 烧碱、小苏打、氢氧化铝均可用于治疗胃酸过多 | |
| C. | 工业生产中,常将氯气通入澄清石灰水中,制取漂白粉 | |
| D. | 除去CuSO4溶液中的Fe2(SO4)3,加入足量CuO粉末,充分搅拌过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 果糖 | B. | 麦芽糖 | C. | 淀粉 | D. | 蔗糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com