
| A、0.1mol/L |
| B、0.9mol/L |
| C、1.8mol/L |
| D、1.9mol/L |


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
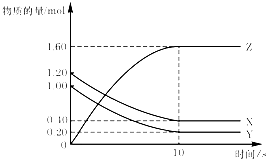
| A、平衡时X、Y的转化率相同 |
| B、该反应的化学方程式为:X(g)+Y(g)?2Z(g) |
| C、T℃时,若起始时X为2.00 mol,Y为2.00 mol,达平衡时Y的体积分数与原平衡Y的体积分数相同 |
| D、达到平衡后,将容器体积扩大为4L,平衡向逆反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH=2 |
| B、c(Na+)=0.01 mol/L≥c(B2-) |
| C、c (H+)?c(OH-)=10-14 |
| D、c(Na+)+c(H+)=c(HB-)+c(B2-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、化合物A分子中含有手性碳原子 |
| B、1mol化合物A与H2加成时最多可消耗1mol H2 |
| C、化合物A分子中所有碳原子共平面 |
| D、化合物A在浓硫酸作用下加热可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、33.3% | B、40% |
| C、50% | D、66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、13.5g | B、9g |
| C、27g | D、0.33mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙烯分子中3个碳原子在同一直线上 |
| B、丙烯分子存在非极性键 |
| C、丙烯分子中3个碳原子都是sp3杂化 |
| D、丙烯分子有7个σ键,1个π键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com