
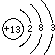 .
.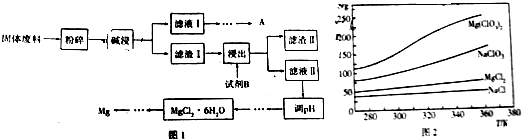
分析 固体废料中含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3,经碱浸后分离,得到滤液Ⅰ主要含有NaAlO2,可回收金属Al,滤渣Ⅰ含有MgCO3、MgSiO3、CaMg(CO3)2、Fe2O3等,加入盐酸浸泡,得到滤渣Ⅱ含有硅酸,滤液Ⅱ含有氯化镁、氯化钙以及氯化铁等,调节溶液pH,可除去氯化铁、氯化钙等,得到氯化镁晶体,最终电解熔融的氯化镁可得到镁,以此解答该题.
解答 解:固体废料中含有MgCO3、MgSiO3、CaMg(CO3)2、Al2O3和Fe2O3,经碱浸后分离,得到滤液Ⅰ主要含有NaAlO2,可回收金属Al,滤渣Ⅰ含有MgCO3、MgSiO3、CaMg(CO3)2、Fe2O3等,加入盐酸浸泡,得到滤渣Ⅱ含有硅酸,滤液Ⅱ含有氯化镁、氯化钙以及氯化铁等,调节溶液pH,可除去氯化铁、氯化钙等,得到氯化镁晶体,最终电解熔融的氯化镁可得到镁,
(1)氧化铝能溶于氢氧化钠,生成偏铝酸钠和水,含有的金属离子的主要成分为Na+、AlO2-,碱浸后的滤液中含有的金属是Al,Al有3个电子层,最外层电子数为3,Al的原子结构示意图为: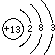 ,
,
故答案为:Na+、AlO2-;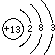 ;
;
(2)由以上分析可知试剂B为盐酸,从化学反应速率和化学平衡的影响因素来看,可以通过增大接触面积提高反应速率,提高镁的浸出率,可通过升高温度提高氯化镁的溶解度,或通过搅拌使反应物充分接触反应,或通过过滤后滤渣多次浸取以提高转化率,
故答案为:盐酸;研磨固体废料;增大盐酸浓度;加热升高温度、边加盐酸边搅研拌;
(3)①依据题意得出反应物为:NaClO3和MgCl2,生成物为:Mg(ClO3)2,故化学反应方程式为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓,在相同温度下,由于NaCl溶解度较小最先析出,在降温的过程中,Mg(ClO3)2的溶解度也不断减小,从溶液中析出,通过蒸发结晶即可获取,
故答案为:2NaClO3+MgCl2=Mg(ClO3)2+2NaCl↓;在相同温度下,由于NaCl溶解度较小最先析出,Mg(ClO3)2剩余在溶液中通过蒸发结晶可得;
②从溶液中得到晶体,可进行蒸发浓缩、冷却结晶,故答案为:蒸发浓缩、冷却结晶.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,以及对离子反应实质的认识,为高考常见题型,同时考查应用基础知识解决简单化学问题的能力以及对图表的观察、分析能力,物质溶解度概念的应用,晶体析出的方法,杂质离子的除杂原则和试剂选择,题目难度较大.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:填空题
| 周期\族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | O |
| 1 | A | |||||||
| 2 | E | F | G | R | ||||
| 3 | B | C | D | H |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| a | b | c | d | |
| n(A)/mol | 2.0 | 1.2 | 2 | 3.6 |
| n(B)/mol | 1.2 | 0.4 | 1 | 1.5 |
| n(c)/mol | 0.1 | 0 | 0.5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
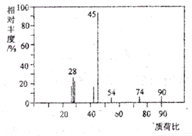 有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.
有机物A常用于食品行业.已知9.0gA在足量O2中充分燃烧,混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 阳离子就是一个质子 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com