
| A、若大量浓硫酸洒在皮肤上应立即用纱布拭去,再用大量水冲洗 |
| B、稀释时要将水沿器壁慢慢倒入浓硫酸中,并用玻璃棒不断搅拌 |
| C、欲除去NH3中的H2O,可让混合气体通过盛有浓硫酸的洗气瓶 |
| D、浓硫酸不分解,不挥发,所以能敞口放置在空气中,质量不会发生变化 |


科目:高中化学 来源: 题型:
 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| TiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
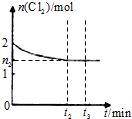 光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.
光气(COCl2)、联氨(N2H4)和H2O2具有重要的工业价值.| 容器 | 反应物 投入的量 | 平衡时 n(Cl2)/mol | 达到平衡 所需时间/min | 平衡时 能量变化/kJ |
| 甲 | 1mol COCl2 | n1 | t1 | 吸热Q1 |
| 乙 | 2mol Cl2和2mol CO | n2 | t2 | 放热Q2 |
| 丙 | 2mol COCl2 | n3 | t3 | 吸热Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、CO2和NO2都是可形成酸雨的气体 |
| B、棉、麻和油脂都是高分子化合物 |
| C、氧化铝陶瓷和光导纤维都是无机非金属材料 |
| D、纤维素在人体内可水解成葡萄糖,供人体组织的营养需要 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+和K+ |
| B、Al3+和Na+ |
| C、Fe2+和NH4+ |
| D、Fe2+和K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| v(N2) |
| v(O2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②④ | B、①②③ |
| C、①②③④ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2通入NaOH溶液:Cl2+OH-→Cl-+ClO-+H2O |
| B、用CH3COOH溶解CaCO3:CaCO3+2H+→Ca2++H2O+CO2↑ |
| C、Cu溶于稀HNO3:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
| D、AlCl3溶液中加入过量稀氨水:Al3++4NH3?H2O→AlO2-+4NH4++2H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com