

分析 (1)废旧锌锰干电池剥离出的黑色粉末中含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰;
(2)还原过程中草酸将二氧化锰还原成硫酸锰;根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,据此分析;
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,根据元素守恒可书写化学方程式;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,据此答题.
解答 解:(1)废旧锌锰干电池剥离出的黑色粉末中含有碳粉和二氧化锰,碳有还原性,在加热时可将二氧化锰还原成氧化锰,反应的化学方程式为2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑,
故答案为:2MnO2+C=2MnO+CO2↑或MnO2+C=MnO+CO↑;
(2)还原过程中草酸将二氧化锰还原成硫酸锰,反应方程式为MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O,根据题中现象描述可知,在酸性条件下双氧水能溶解二氧化锰,说明二氧化锰能氧化双氧水,在碱性条件下,加入双氧水,发现黑色固体不减反增,说明溶液中的锰离子变成了二氧化锰,即双氧水将锰离子氧化成了二氧化锰,反应方程式为Mn2++H2O2+2OH-=MnO2↓+2H2O,比较甲、乙两位组员实验可得出的结论是酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2,
故答案为:MnO2+H2C2O4+H2SO4=MnSO4+2CO2↑+2H2O;Mn2++H2O2+2OH-=MnO2↓+2H2O;酸性条件下氧化性MnO2>H2O2,碱性条件下氧化性MnO2<H2O2;
(3)操作1和操作2都是分离固体和液体,都使用过滤的装置,操作3是分离氯化锌和氯化铵,用重结晶的方法,
故答案为:重结晶;
(4)硫酸锰中加入碳酸氢铵溶液生成碳酸锰,同时有气泡产生应为二氧化碳,反应的化学方程式为MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O,
故答案为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(5)在锌锰干电池中,二氧化锰是氧化剂,在正极发生还原反应生成MnOOH,电极反应式为MnO2+NH4++eˉ=MnO(OH)+NH3,电解MnSO4溶液时,阳极上是水电离出的氢氧根离子放电生成氧气,阴极上是锰离子得电子生成锰,阳极的电极反应式为2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O),
故答案为:MnO2+NH4++eˉ=MnO(OH)+NH3;2H2O-4eˉ=O2↑+4H+(或4OH--4eˉ=O2↑+2H2O).
点评 本题考查了物质制备方案设计,为高频考点,侧重于学生的分析、实验能力的考查,题目涉及离子方程式的书写、电极反应式的书写、氧化还原反应等知识,题目难度中等,注意把握实验的流程以及相关物质的性质.


科目:高中化学 来源: 题型:选择题
| A. | 向Ge(OH)4中加入盐酸:OH-+H+═H2O | |
| B. | MnO2 与浓盐酸反应制Cl2:MnO2+4HCl═Mn2++2Cl-+Cl2↑+2H2O | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-═I2+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
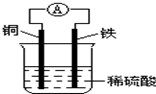
| A. | 铜棒逐渐溶解 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 负极反应式为Fe-2e-=Fe2+,发生还原反应 | |
| D. | 电子由铁棒通过导线流向铜棒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
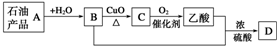
| A. | A能使酸性高锰酸钾溶液褪色 | B. | 可用B萃取碘水中的碘单质 | ||
| C. | B与乙酸发生了取代反应 | D. | D的结构简式为CH3COOCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
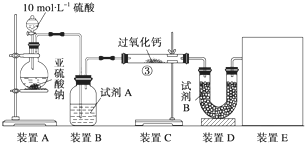
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
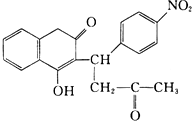
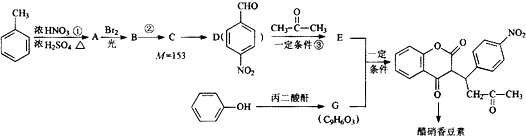
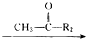 R1-CH═
R1-CH═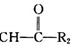 +H2O
+H2O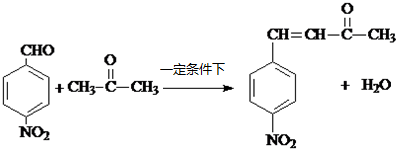 .
.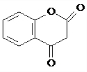 .
.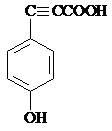 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 装 置 图 |  | 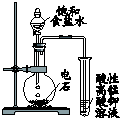 | 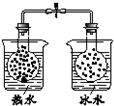 |  |
| 现 象 | 导管中液面上升 | KMnO4溶液褪色 | 热水中的NO2球红棕色加深 | 白色沉淀逐渐转化为黄色沉淀 |
| 结 论 | 该条件下,铁钉发生吸氧腐蚀 | 电石和水反应生成乙炔 | 2NO2(g)?N2O4(g)△H<0 | Ksp:AgCl>AgI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
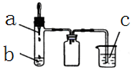 利用如图所示装置进行下列实验,实验现象与结论均正确的是( )
利用如图所示装置进行下列实验,实验现象与结论均正确的是( )| 选项 | 实验试剂 | 实验现象 | 实验结论 | ||
| a | b | c | |||
| A | 浓氨水 | 碱石灰 | FeCl2溶液 | 产生白色沉淀,迅速变为灰绿色,最后变为红褐色 | 氨气具有氧化性 |
| B | 稀硫酸 | FeS | AgCl悬浊液 | 悬浊液由白色变为黑色 | Ksp(AgCl)>Ksp(Ag2S) |
| C | 浓硝酸 | 铜 | BaSO3悬浊液 | 悬浊液变澄清 | +4价硫具有还原性 |
| D | 浓盐酸 | KMnO4 | 紫色石蕊试液 | 溶液先变红后褪色 | Cl2有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com