
【题目】下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有 K+、Fe3+、Cu2+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子,该小组同学取 100 mL 水样进行实验:向样品中先滴加氯化钡溶液,再滴加 1 mol·L-1 盐酸,实验过程中沉淀质量的变化如图所示。下列说法正确的是

A. 水样中一定不存在Fe3+、Cu2+,可能存在Ag+
B. 水样中一定存在CO32-、SO42-、Cl-
C. BC段曲线所表示的离子方程式为CO32-+2H+=H2O+CO2↑
D. 水样中一定存在K+,且c(K+)≥0.6mol·L-1
【答案】D
【解析】该水样为无色溶液,水样中一定不存在Fe3+、Cu2+;依据图象分析加入氯化钡溶液生成沉淀,加入稀硝酸,沉淀部分溶解证明水样中一定含有SO42-、CO32-,又因为CO32-与Ag+、Ca2+发生反应生成沉淀不能大量存在,所以Ag+、Ca2+不存在;n(SO42-)=![]() =0.01mol,n(CO32-)=n(BaCO3)=
=0.01mol,n(CO32-)=n(BaCO3)= ![]() =0.02mol;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol;A.据此分析可知,水样中一定不存在Fe3+、Cu2+、Ag+,故A错误;B.溶液是电中性的,则水样中一定存在CO32-、SO42-、K+,可能含有Cl-,故B错误;C.BC段曲线是溶解碳酸钡沉淀,所表示的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑,故C错误;D.水样中一定存在K+,且c(K+)≥
=0.02mol;原溶液中可能含有Cl-,依据电解质溶液中电荷守恒,阳离子K+一定存在;根据电荷守恒得到:0.01mol×2+0.02mol×2+n(Cl-)=n(K+)推知n(K+)≥0.06mol;A.据此分析可知,水样中一定不存在Fe3+、Cu2+、Ag+,故A错误;B.溶液是电中性的,则水样中一定存在CO32-、SO42-、K+,可能含有Cl-,故B错误;C.BC段曲线是溶解碳酸钡沉淀,所表示的离子方程式为BaCO3+2H+=Ba2++H2O+CO2↑,故C错误;D.水样中一定存在K+,且c(K+)≥![]() =0.6mol·L-1,故D正确;答案为D。
=0.6mol·L-1,故D正确;答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】雌黄 As2S3 和雄黄 As4S4 都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有 抗病毒疗效也用来入药。
(1)砷元素有+2、+3 两种常见价态。雄黄在空气中加热至 300℃时会生成两种氧化物,其 中一种氧化物为剧毒的砒霜(As2O3),则物质 a 是_____,可用双氧水将 As2O3 氧化为 H3AsO4,写出该反应的化学方程式:________。

(2)亚砷酸 H3AsO3 可以用于治疗白血病,其在溶液中 存在多种微粒形态,25℃时,各种微粒物质的量分数与 溶液的 pH 关系如图所示。
①人体血液的 pH 在 7.35 ~7.45 之间,用药后人体中 含砷元素的主要微粒是_____。
②下列说法不正确的是_____(填字母序号)。
A.n(H3AsO3):n(H2AsO3-)=1:1 时,溶液显碱性
B.25℃时,H3AsO3 的第一电离平衡常数的值 Ka1=10-5
C.在 K3AsO3 溶液中, c(AsO33-)>c(HAsO32-)>c(H2AsO3-)
③将 KOH 溶液滴人亚砷酸溶液,当 pH 调至 11 时发生反应的离子方程式 是_____。
(3)P 和 As 属于同主族元素,存在亚磷酸(H3PO3),该酸与足量的 NaOH 溶液反应生成Na2HPO3。工业电解 Na2HPO3 溶液可得到亚磷酸,装置示意图如下:

①产品室中反应的离子方程式为_____;
②得到 1mol 亚磷酸的同时,阴极室制得 NaOH 质量为_____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中,不正确的是
A. 用半透膜除去淀粉胶体中的Na+、Cl-
B. 胶体中分散质粒子的直径在1nm~100nm之间
C. 利用丁达尔效应可以区分溶液和胶体
D. 用滤纸能分离胶体和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,32g金属铜与足量某浓度的硝酸完全反应,生成NO2和NO的物质的量之比为1∶3,则反应过程中转移的电子为( )
A.1 mol B.2 mol C.3mol D.4 mo1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分子式为C5Hl2O并能与金属钠反应放出H2的有机化合物有________种;
(2)下列说法错误的是_____________;
A.有机物均易燃烧
B.苯酚酸性比碳酸弱,故苯酚不能与碳酸钠溶液反应
C.制取乙酸乙酯时,试剂的混合顺序是先加浓硫酸,再加乙醇,然后加乙酸
D.石油分馏得到的汽油是纯净物
(3)分子式为C5H9C1O2的同分异构体甚多,其中能与NaHCO3发生反应产生CO2的同分异构体共有________种;
(4)分子式为C3H6O2的链状有机物,核磁共振氢谱上峰的数目及强度比分别为:①3∶3;②3∶2∶1;③3∶1∶1∶1;④2∶2∶1∶1,则它们可能的结构简式依次为:
①_______________;②______________;
③_______________;④__________________。
(5)苯氧乙酸(![]() )有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_______________(写出任意2种的结构简式)
)有多种酯类的同分异构体,其中能与FeCl3溶液发生显色反应,且苯环上有2种一硝基取代物的同分异构体是_______________(写出任意2种的结构简式)
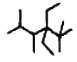
(6)按系统命名法,右图化合物的名称是___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属晶体和离子晶体的说法中错误的是 ( )
A. 都可采取“紧密堆积”的结构B. 都含离子
C. 一般具有较高的熔点和沸点D. 都能导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为解决能源短缺问题,工业生产中应合理利用化学能。
(1)25 ℃,1.01×105 Pa时,实验测得,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则表示H2的燃烧热的热化学方程式为______________________。
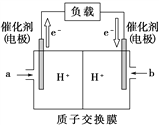
(2)上图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从________处通入(填“a”或“b”),电池内部H+向_______(填“左”或“右”)移动。写出电池负极的电极反应式________。正极的电极反应式_______________________。
(3)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
化学键 | H—H | N—H | N≡N |
键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)===2NH3(g) ΔH=-93 kJ·mol-1。
试根据表中所列键能数据计算a的数值________。
当可逆反应中净生成N—H物质的量为2mol 时,反应放热_____________。
(4)已知:C(s,石墨)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1 ①
2H2(g)+O2(g)===2H2O(l) ΔH2=-571.6 kJ·mol-1 ②
2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH3=-2599 kJ·mol-1 ③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)===C2H2(g)的ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲烷在空气中燃烧生成二氧化碳和水,同时产生淡蓝色火焰,下列说法正确的是
A. 形成H-O键吸收能量 B. 该反应是吸热反应
C. 断裂C-H键放出热量 D. 该反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com