
分析 Ⅰ、实验室以废铜屑、稀硫酸、氨水为主要原料合成[Cu(NH3)4]x(SO4)y•zH2O,其合成路线为:将废铜屑灼烧生成CuO,再稀硫酸溶解得溶液A为硫酸铜溶液,在硫酸铜溶液中加氨水得悬浊液B为氢氧化铜悬浊液,继续加氨水形成铜氨配合离子,所以溶液C为[Cu(NH3)4]x(SO4)y溶液,在溶液C中加入乙醇,经减压过滤、洗涤、干燥得晶体,
(1)油污在灼烧时会生成二氧化碳和水而除去,不影响后续实验;
(2)晶体在乙醇溶液中溶解度会减小,铜离子水解,加热后氨气挥发,会促使铜离子水解生成氢氧化铜;
(3)用乙醇和浓氨水的混合物洗涤晶体,可以减少晶体的损失,[Cu(NH3)4]SO4•H2O受热易分解,所以不宜用加热的方法干燥;
Ⅱ、NH3的测定:将晶体溶于水,加入足量的氢氧化钠溶液,加热,使氨气逸出,用一定量 的盐酸吸收,再用氢氧钠溶液测定未反应的盐酸,根据与氨气反应的盐酸可计算出逸出的氨气的物质的量,
(4)装置中长颈漏斗插入小试管起液封的作用,可以防止氨气跑到空气中,同时可以减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗;
(5)蒸氨过程中锥形瓶内铜离子水解生成氢氧化铜,氢氧化铜受热分解生成氧化铜;铜氨配合离子的溶液呈深蓝色,而铜离子的水溶液呈蓝色,据此判断;
(6)根据题意,用于滴定盐酸的氢氧化钠的物质的量为c2 mol•L-1×V2 ml,则与氨气反应的盐酸的物质的量为V1mL×c1mol•L-1-c2 mol•L-1×V2 ml,据此可求得样品中NH3的质量,再结合样品的质量可求得氨气的分数;
(7)[Cu(NH3)4]x(SO4)y•zH2O晶体中硫酸根和水的质量分数分别为39.02%和7.32%,可得方程组$\left\{\begin{array}{l}{\frac{96y}{132x+96y+18z}=39.02%}\\{\frac{18z}{132x+96y+18z}=7.32%}\end{array}\right.$,根据方程组可确定x:y:z的值,进而确定晶体的化学式;
解答 Ⅰ、实验室以废铜屑、稀硫酸、氨水为主要原料合成[Cu(NH3)4]x(SO4)y•zH2O,其合成路线为:将废铜屑灼烧生成CuO,再稀硫酸溶解得溶液A为硫酸铜溶液,在硫酸铜溶液中加氨水得悬浊液B为氢氧化铜悬浊液,继续加氨水形成铜氨配合离子,所以溶液C为[Cu(NH3)4]x(SO4)y溶液,在溶液C中加入乙醇,经减压过滤、洗涤、干燥得晶体,
(1)油污在灼烧时会生成二氧化碳和水而除去,不影响后续实验,所以但本实验并不需要用热的碱液浸泡以除去其表面的油污,
故答案为:灼烧时油污生成CO2和H2O而除去;
(2)晶体在乙醇溶液中溶解度会减小,所以试剂D为乙醇,若操作过程不加入试剂D而是加热蒸发、冷却结晶,则铜离子水解,加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解,会生成Cu(OH)2[或Cu2(OH)2SO4],所以会有杂质Cu(OH)2[或Cu2(OH)2SO4],
故答案为:无水乙醇;Cu(OH)2[或Cu2(OH)2SO4];加热蒸发过程中NH3挥发,使反应[Cu(NH3)4]2+?Cu2++4NH3平衡往右移动,且Cu2+发生水解;
(3)用乙醇和浓氨水的混合物洗涤晶体,可以减少晶体的损失,[Cu(NH3)4]SO4•H2O受热易分解,所以不宜用加热的方法干燥,
故答案为:①减少粗产品的溶解损耗;②加热易使[Cu(NH3)4]SO4•H2O分解;
Ⅱ、NH3的测定:将晶体溶于水,加入足量的氢氧化钠溶液,加热,使氨气逸出,用一定量 的盐酸吸收,再用氢氧钠溶液测定未反应的盐酸,根据与氨气反应的盐酸可计算出逸出的氨气的物质的量,
(4)装置中长颈漏斗插入小试管起液封的作用,可以防止氨气跑到空气中,同时可以减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗,
故答案为:液封并减少NaOH溶液的用量,可以控制反应的开始及速率作用同分液漏斗;
(5)蒸氨过程中锥形瓶内铜离子水解生成氢氧化铜,氢氧化铜受热分解生成氧化铜,化学式为CuO,铜氨配合离子的溶液呈深蓝色,而铜离子的水溶液呈蓝色,所以氨完全蒸出的标志为 溶液不再为深蓝色,
故答案为:CuO;溶液不再为深蓝色;
(6)根据题意,用于滴定盐酸的氢氧化钠的物质的量为c2 mol•L-1×V2 ml,则与氨气反应的盐酸的物质的量为V1mL×c1mol•L-1-c2 mol•L-1×V2 mL,所以样品中NH3的质量为17g/mol×(V1L×c1mol•L-1-c2 mol•L-1×V2 L)×10-3=0.017(c1V1-c2 V2 )g,样品中氨气的分数为$\frac{0.017({{{c}_{\;}}_{1}}_{\;}{V}_{1}-c{\;}_{2}{V}_{2})g}{ag}$×100%=$\frac{1.7({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{ag}$%,
故答案为:$\frac{1.7({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{ag}$%;
(7)[Cu(NH3)4]x(SO4)y•zH2O晶体中硫酸根和水的质量分数分别为39.02%和7.32%,可得方程组$\left\{\begin{array}{l}{\frac{96y}{132x+96y+18z}=39.02%}\\{\frac{18z}{132x+96y+18z}=7.32%}\end{array}\right.$,根据方程组知x:y:z=1:1:1,所以晶体的化学式为[Cu(NH3)4]SO4•H2O,
故答案为:[Cu(NH3)4]SO4•H2O.
点评 本题考查物质的制备,涉及化学平衡移动、结晶方式的分析、化学计算等,弄清实验原理、目的、要求、步骤和注意事项是解题的关键,中等难度.


科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 11 | C. | 10 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离平衡正向移动,c(H+)增大 | |
| B. | HF的电离程度增大,c(H+)、c(F-)增大,c(HF)减小 | |
| C. | 稀释过程中,c(OH-)增大 | |
| D. | 溶液的KW、pH均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
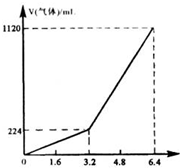 将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.
将一定量混合均匀的铁粉与硫粉在隔绝空气的条件下共热,充分反应后冷却至室温,得到固体A.将质量为m的固体A加入到300mL 2mol/L盐酸中使之完全溶解.测得室温下加入固体A的质量与收集到气体体积(已换算成标准状况)的关系如图所示(假设所得氢硫酸溶液饱和前无硫化氢气体逸出).已知:①加入固体A的质量m≤3.2g时,收集到的气体为H2;②当m>3.2g时,收集到的气体为H2和H2S的混合气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com