
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
| 化学平衡建立的过程. | |
| 专题: | 化学平衡专题. |
| 分析: | A、根据各物质表示的化学反应速率之比等于系数之比来计算; B、反应物的转化率和反应物的初始浓度以及变化浓度有关系; C、化学平衡状态的标志是:正逆反应速率相等; D、极限假设0.08mol/L的氨气全部为生成时,则此时氮气的浓度存在极大值. |
| 解答: | 解:A、“达平衡时X、Y的浓度分别为0.1mol/L,0.3mol/L”,则浓度之比是1:3;反应中无论是消耗它们还是生成它们,变化浓度之比肯定也是1:3;末态浓度加消耗掉浓度,所以,起始时也一定是1:3,故A正确; B、如上A所述,X、Y的起始浓度之比是1:3,消耗浓度之比一定是1:3,所以它们的转化率相等,故B错误; C、H2的生成速率是V逆,NH3的生成速率是V正,同一个反应速率用不同的物质表示时,数值与它们的系数成正比,所以H2和NH3的生成速率之比为3:2才表示V正=V逆,故C正确; D、如果起始时c3=0,则平衡时NH3的浓度0.08mol/L,就是反应生成的,这需要0.04mol/L的N2,平衡时N2的浓度为0.1mol/L,所以起始时就应该是0.1+0.04=0.14 mol/L,但是题目已知起始时NH3的浓度不等于0,C1的取值范围为0.04mol•L﹣1<C1<0.14mol•L﹣1,故D正确. 故选B. |
| 点评: | 本题是一道关于化学平衡知识的计算题,考查学生分析和解决问题的能力,综合性强,难度大. |


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案科目:高中化学 来源: 题型:
已知:Fe2O3+3CO═2Fe+3CO2.
(1)标出该反应中电子转移的方向和数目.
(2)指出该反应中,氧化剂是,还原剂是.
(3)若有2mol电子发生转移,在标准状况下,计算生成CO2的体积.
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列几种物质熔点和沸点的数据,判断下列说法中错误的是( )
| NaCl | MgCl2 | AlCl3 | SiCl4 | 单质B | |
| 熔点/℃ | 810 | 710 | 190 | -68 | 2 300 |
| 沸点/℃ | 1 465 | 1 418 | 182.7 | 57 | 2 500 |
注:AlCl3熔点在2.5×105Pa条件下测定。
A.SiCl4是分子晶体
B.单质B是原子晶体
C.AlCl3加热能升华
D.MgCl2所含离子键的强度比NaCl大
查看答案和解析>>
科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) |
|
| C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
|
| A. | 在高温下,将氯化铵晶体加入处于平衡状态的合成氨反应时,平衡不发生移动 |
|
| B. | 在密闭容器中,当CaCO3(s)⇌CaO(s)+CO2(g)处于平衡状态时,再加入Na2O2固体CaCO3的量会减少 |
|
| C. | 有固体参加的可逆反应达平衡后,若改变压强,不会影响平衡的移动 |
|
| D. | 在合成氨反应中,使用催化剂能提高反应速率,使氨的质量分数增加,从而增加氨的产量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 .
(2)该反应的正反应是 反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol•L﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正 v逆 (填“>”、“<”或“=”).
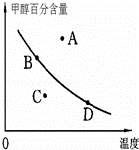
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 点.比较图中B、D两点所对应的正反应速率B D(填“>”、“<”或“=”).理由是 .
(4)一定条件下要提高反应物的转化率,可以采用的措施是
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.
查看答案和解析>>
科目:高中化学 来源: 题型:
利用海水制备部分物质的流程图如下。下列有关说法正确的是

A.电解熔融氯化镁制备镁,副产物氯气可以用于制盐酸,循环利用
B.联合制碱法最终副产物为氯化铵,原子利用率小于100%
C.步骤②的操作是:在空气中加热氯化镁晶体得到无水氯化镁
D.海水中离子的浓度较小,上述流程图只涉及溴元素的富集过程
查看答案和解析>>
科目:高中化学 来源: 题型:
将1molSO2和1molO2通入一容积不变的密闭容器中,在一定温度和催化剂作用下发生反应 SO2(g)+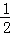 O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
O2(g)⇌SO3(g).达到平衡后SO3为0.3mol,此时若移走0.5molSO2和0.5mol O2,则重新达到平衡后SO3物质的量为( )
|
| A. | 等于0.3mol | B. | 等于0.15mol |
|
| C. | 小于0.15mol | D. | 大于0.15mol,小于0.3mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com