
【题目】下列离子方程式正确的是( )
A.NH4HCO3溶于过量的浓KOH溶液中:HCO![]() +2OH-=CO
+2OH-=CO![]() + H2O
+ H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全:2Al3++3SO
沉淀完全:2Al3++3SO![]() +3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入足量氯气:2Fe2++2Br-+2Cl2=2 Fe3++Br2+4 Cl-
D.向氢氧化铁中加入HI溶液:2Fe(OH)3+6H+ +2I—= 2Fe2+ + I2 +6 H2O
【答案】D
【解析】
A.NH4HCO3溶于过量的浓KOH溶液中,![]() 也会与OH-反应生成NH3和H2O,正确的离子方程式为
也会与OH-反应生成NH3和H2O,正确的离子方程式为![]() +HCO
+HCO![]() +2OH-=NH3↑+CO
+2OH-=NH3↑+CO![]() +2H2O,A选项错误;
+2H2O,A选项错误;
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO![]() 沉淀完全,正确的离子方程式为Al3++2SO
沉淀完全,正确的离子方程式为Al3++2SO![]() +2Ba2++4OH-=2H2O+2BaSO4↓+
+2Ba2++4OH-=2H2O+2BaSO4↓+![]() ,B选项错误;
,B选项错误;
C.因为氯气过量,所以将FeBr2全部氧化,正确的离子方程式为2Fe2++4Br-+3Cl2=2 Fe3++2Br2+6Cl-,C选项错误;
D.向氢氧化铁中加入HI溶液,氢氧化铁和氢离子发生中和反应生成Fe3+和H2O,Fe3+具有氧化性,且氧化性强于I2,所以Fe3+能够把I-氧化为I2,正确的离子方程式为2Fe(OH)3+6H+ +2I-=2Fe2++I2+6H2O,D选项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】25℃时,向1L0.01 molL-1H2B溶液中滴加盐酸或NaOH溶液,溶液中 c(H2B)、c(HB-)、c(B2-)、c(OH-)、c(H+) 的对数值(lgc)与pH的关系如图所示(温度保持不变),下列说法错误的是
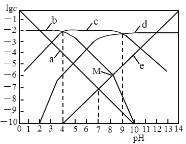
A.曲线c表示lgc(HB-)与pH的关系
B.随pH增加,c(H2B)c(OH-)增大
C.0.01 molL-1Na2B溶液,Kh1(B2-)的数量级为10-9
D.M点溶液中n(Na+)+n(H+)―n(B2-)=0.01mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
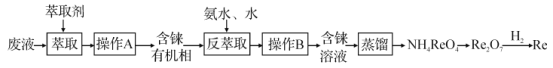
A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4-
B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用
C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re
D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___,本实验中最容易产生的副产物的结构简式为___。
(2)仪器b的作用为___。
(3)混合液用5%Na2CO3溶液洗涤的目的是___。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
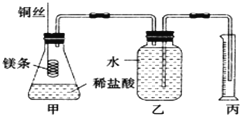
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100mL 1.0mol/L的盐酸溶液,需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、______;
②用10mL量筒量取8.0mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为VmL。
请回答下列问题。
(1)步骤①中,配制100mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低_____(填写字母)
A. 用量筒量取浓盐酸时,俯视量筒的刻度
B. 容量瓶未干燥即用来配制溶液
C. 未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤①__________ 步骤③__________
(3)实验步骤⑤中应选用________的量筒(填字母).
A.100mL B.200mL C.500mL
(4)读数时需要注意(至少写两点)____________
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=____L/mol。(用含V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X,它们有如图所示的转化关系(部分产物及反应条件已略去)。下列判断正确的是( )
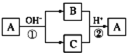
A.X元素可能为AlB.反应①和②互为可逆反应
C.X元素可能为SiD.反应①和②一定为氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是( )
A.工业生产环氧乙烷:![]()
B.水煤气合成甲醇:CO + 2H2 CH3OH
CH3OH
C.制取硫酸铜:Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
D.合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年5月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:
下列说法正确的是( )
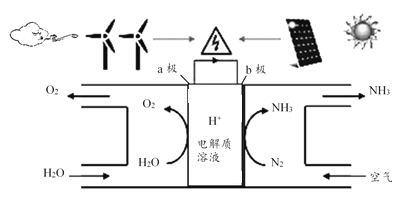
A. 图中能量转化方式只有2种
B. H+向a极区移动
C. b极发生的电极反应为:N2+6H++6e-=2NH3
D. a极上每产生22.4LO2流过电极的电子数一定为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是短周期元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。
(1)NW3的电子式为___,HWO的结构式为__,Z在元素周期表中的位置是__,XO2分子中X原子采用杂化方式___。
(2)①X、Y、Z、W原子半径由大到小依次是___(填元素符号)。
②X、Z、W最高价氧化物水化物酸性由强到弱依次是__(填化学式)。
(3)X、Y、Z、W中第一电离能最小的是___,电负性最大的是___(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com