
【题目】现有部分元素的性质、用途与原子(或分子)结构如表所示:
元素编号 | 元素性质与原子(或分子)结构 |
W | 周期表中原子半径最小的元素 |
X | 氢化物可与其最高价氧化物的水化物反应生成盐 |
Y | 一种核素在考古时常用来鉴定一些文物的年代 |
Z | M层比K层少1个电子 |
T | 存在两种同素异形体,其中一种可吸收紫外线 |
(1)元素Y在周期表中的位置第 , 元素T的简单离子结构示意图 .
(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式 .
(3)元素W与元素X、T可以分别形成多种核外电子总数为10的微粒,其中有四种微粒可以发生反应:甲+乙 ![]() 丙+丁,该反应为: .
丙+丁,该反应为: .
(4)元素X与元素W以原子个数比1:2化合形成常用于火箭燃料的化合物戊,元素T和元素W以原子个数比为1:1化合形成化合物己,戊与己能发生氧化还原反应,生成X单质和另一种液体化合物,写出该反应的化学方程式 .
【答案】
(1)二周期ⅡA族;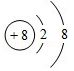
(2)![]()
(3)NH4++OH﹣ ![]() NH3↑+H2O
NH3↑+H2O
(4)N2H4+2H2O2=N2↑+4H2O
【解析】解:W是周期表中原子半径最小的元素,则W为H元素;X的氢化物可与其最高价氧化物的水化物反应生成盐,则X为N元素;Y的一种核素在考古时常用来鉴定一些文物的年代,则Y为C元素;Z的M层比K层少1个电子,则Z的M层含有1个电子,为Na元素;T存在两种同素异形体,其中一种可吸收紫外线,T为O元素,(1)元素Y为C,原子序数为6,在周期表中位于二周期ⅡA族;元素T为O,O的简单离子为氧离子,其核电荷数为8、核外电子总数为10,其离子结构示意图为:,所以答案是:二周期ⅡA族; 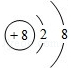 ;(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,该化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为
;(2)W、X、Z、T中有两种元素能形成既有离子键又有非极性共价键的化合物,该化合物为过氧化钠,Na2O2是钠离子和过氧根离子构成的离子化合物,钠离子失电子形成阳离子,过氧根离子得到电子形成阴离子,电子式为 ![]() , 所以答案是:
, 所以答案是: ![]() ;(3)W、X、T分别为H、N、O元素,H与N、O形成的10电子微粒有:NH3、H2O、NH4+、OH﹣等,其中有四种微粒可以发生反应:甲+乙
;(3)W、X、T分别为H、N、O元素,H与N、O形成的10电子微粒有:NH3、H2O、NH4+、OH﹣等,其中有四种微粒可以发生反应:甲+乙 ![]() 丙+丁,反应方程式为:NH4++OH﹣
丙+丁,反应方程式为:NH4++OH﹣ ![]() NH3↑+H2O,所以答案是:NH4++OH﹣
NH3↑+H2O,所以答案是:NH4++OH﹣ ![]() NH3↑+H2O;(4)氧元素与氢元素形成的原子个数比为1:1的化合物己为H2O2 , 氮元素与氢元素形成的原子个数为1:2的化合物戊是N2H4 , 两者反应可生成X单质(N2)和另一种液体化合物(H2O),该反应的化学方程式为:N2H4+2H2O2=N2↑+4H2O,所以答案是:N2H4+2H2O2=N2↑+4H2O.
NH3↑+H2O;(4)氧元素与氢元素形成的原子个数比为1:1的化合物己为H2O2 , 氮元素与氢元素形成的原子个数为1:2的化合物戊是N2H4 , 两者反应可生成X单质(N2)和另一种液体化合物(H2O),该反应的化学方程式为:N2H4+2H2O2=N2↑+4H2O,所以答案是:N2H4+2H2O2=N2↑+4H2O.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】氮及其化合物在生产、生活中有着重要的作用。

请回答下列问题:
(1)图1是常温下1 mol NO2和1 mol CO反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:____________________________。
(2)如图2,在恒温、恒容的密闭容器中,通入一定量的N2O4发生反应N2O4(g)![]() 2NO2(g) ΔH。
2NO2(g) ΔH。
①在0~60 s时间段,反应速率v(N2O4)为____ mol·L-1·s-1。
②温度升高,混合气体的颜色变深,则ΔH____0(填“>”或“<”)。
③改变条件重新达到平衡时,要使N2O4的体积分数变大,可采取的措施有____(填字母)。
a.向混合气体中通入N2O4 b.升高温度
c.向混合气体中通入NO2 d.使用高效催化剂
(3)实验室可用NaOH溶液吸收NO2,发生反应的化学方程式为2NO2+2NaOH![]() NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液。
NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液与0.2 mol NO2恰好完全反应得1 L溶液A,溶液B为0.1 mol·L-1的CH3COONa溶液。
①A、B两溶液中c(NO3-)、c(NO2-)和c(CH3COO-)由大到小的顺序为_________________。
(HNO2的电离常数Ka=7.1×10-4 mol·L-1,CH3COOH的电离常数Ka=1.7×10-5 mol·L-1)。
②可使A、B两溶液的pH相等的方法是____(填字母)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
(4)铜既能与稀硝酸反应,也能与浓硝酸反应,当铜与一定浓度硝酸反应时,可将化学方程式表示为Cu+HNO3![]() Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。0.6 mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为____。
Cu(NO3)2+NO↑+NO2↑+H2O(方程式未配平)。0.6 mol Cu被硝酸完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某生物小组进行无土栽培实验,观察不同矿质元素对南瓜植株生长发育的影响。在4组单因素缺素培养实验中,他们观察到其中一组的表现为老叶形态、颜色正常,但幼叶颜色异常,呈黄白色。该组缺乏的元素是
A.K B.P C.Mg D.Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置完成相关实验,合理的是( )。

A. 图①:验证H2CO3酸性强于H2SiO3 B. 图②:收集CO2或NH3
C. 图③:分离Na2CO3溶液与CH3COOC2H5 D. 图④:分离C2H5OH与CH3COOC2H5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钙[Ca(NO2)2]是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去)。

已知:2NO+CaO2=Ca(NO2)2;2NO2+CaO2 =Ca(NO3)2。
请回答下列问题:
a.向装置中通入N2;b.向三颈烧瓶中滴加稀硝酸;c.点燃酒精灯;d.熄灭酒精灯;e.停止通入氮气;f.关闭分液漏斗旋塞
(1)上述操作的正确排序为_________________________。
(2) B中盛放的试剂是_____,作用是除去________(填化学式)。
(3)装置E中,酸性K2Cr2O7溶液的作用:可剩余的NO氧化成NO3-,溶液由橙色变为绿色(Cr3+),反应的离子方程式是____________。
(4)已知Ca(NO2)2溶液需保持弱碱性,因为其遇酸会发生反应,产生NO气体。设计实验证明D中有亚硝酸钙生成_____________。
(5)整个过程持续通人氮气的作用_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的性质是化学研究的主要内容之一。下列叙述正确的是
A. 向Fe(NO3)2溶液中滴加稀盐酸,溶液变黄
B. Na与氧气反应只生成Na2O2
C. 将SO2通入过量BaCl2溶液可生成BaSO3沉淀
D. 向酚酞试液中加足量Na2O2粉末,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各溶液中,离子一定能大量共存的是( )
A. 强碱性溶液中:K+、Al3+、Cl-、SO42—
B. 在无色透明的溶液中:K+、Cu2+、NO3—、SO42—
C. 含有0.1 mol·L1 Ca2+的溶液中:Na+、K+、CO32—、Cl-
D. 室温下,pH=1的溶液中:Na+、Fe3+、NO3—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、L、M为核电荷数依次增大的前20号主族元素。X的原子半径最小,Y、L 与M三种元素的质子数均为5的倍数。回答下列问题:
(1)X与Y组成的化合物属于______(填“共价”或“离子”)化合物.
(2)X与M组成的物质电子式为_____,该物质可作为野外工作的应急燃料,其与水反应的化学方程式为___________。
(3)Y在周期表中的位置是_______,其含氧酸的化学式为_________。
(4)下列说法正确的是______。
A.L可能是Ne,也可能是P
B.L在氯气中燃烧现象为白色烟雾
C.L与X形成的化合物分子构型为平面三角形
D.L有多种氧化物以及含氧酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应CO(g)+H2O![]() CO2+H2 H<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述错误的是( )
CO2+H2 H<0。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述错误的是( )
A. 充入一定量的氮气,n(H2)不变 B. 减小压强,c(CO2)减小
C. 升高温度,![]() 减小 D. 更换高效催化剂,α(CO)增大
减小 D. 更换高效催化剂,α(CO)增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com