
【题目】美国医学家证实了3价铬离子(Cr3+)是构成葡萄糖耐量因子的重要组成部分,能够增强胰岛素的作用。构成葡萄糖耐量因子和蛋白质的元素有C、H、O、N、S、Cr等。
(1)Cr的外围电子排布图为_______________________________ 。
(2)SO2分子的空间构型为__________,是__________ 分子(填“极性”或“非极性”);SO32-离子中心原子的杂化方式为__________。
(3)SCN的电子式为_________________,它的等电子体中属于分子的有___________。
(4)四种分子:①CH4、②SO3、③H2O、④NH3,键角由大到小的排列顺序是________(填序号)。
(5)NH3分子可以与H+ 结合生成NH4+,这个过程发生改变的是_____
a. 微粒的空间构型 b. N原子的杂化类型 c. H-N-H的键角 d. 微粒的电子数
(6)由碳元素形成的某种单质的片状和层状结构如图1所示,由碳元素形成的某种晶体的晶胞结构如图2所示,试回答:
①在图1中,碳原子所形成的六元环数、C原子数、C-C键数之比为_____________;
②在图2中,已知阿伏伽德罗常数为NA,晶体密度为ρ g/cm3,则该晶体的棱长为
________________pm(只列式,不计算)。

【答案】 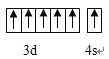 V形 极性分子 SP3
V形 极性分子 SP3 ![]() N2O或CO2或CS2等 ②>①>④>③ a、c 1:2:3
N2O或CO2或CS2等 ②>①>④>③ a、c 1:2:3 ![]()
【解析】(1)考查价电子和电子排布图的书写,Cr位于第四周期VIB族,其价电子为最外层电子和次外层d能级上的电子,因此电子排布图为 ;(2)本题考查空间构型、杂化类型,SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,杂化类型为sp2,空间构型为V型,属于极性分子,SO32-中心原子是S,含有3个σ键,孤电子对数为(6+2-2×3)/2=1,杂化类型为sp3;(3)本题考查电子式的书写和等电子体的判断,SCN-的电子式,要求每个原子达到8电子稳定结构,因此SCN-的电子式为
;(2)本题考查空间构型、杂化类型,SO2中心原子S有2个σ键,孤电子对数为(6-2×2)/2=1,杂化类型为sp2,空间构型为V型,属于极性分子,SO32-中心原子是S,含有3个σ键,孤电子对数为(6+2-2×3)/2=1,杂化类型为sp3;(3)本题考查电子式的书写和等电子体的判断,SCN-的电子式,要求每个原子达到8电子稳定结构,因此SCN-的电子式为![]() ,原子总数相等,价电子总数相等的微粒互为等电子体,因此与SCN-互为等电子体的分子是N2O、CO2、CS2等;(4)本题考查影响键角的因素,①CH4没有孤电子对,属于正四面体结构,键角是10928’,②SO3没有孤电子对,属于平面三角形,键角是120 ,③H2O中心原子O有两个孤电子对,④NH3中心原子有1个孤电子对,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间的斥力,因此键角的大小顺序是②>①>④>③;(5)本题考查杂化类型、键角、电子数、空间构型,a、NH3的空间构型为三角锥形,NH4+空间构型为正四面体,空间构型发生改变,故a正确;b、NH4+、NH3杂化类型都为sp3,故b错误;c、空间构型发生改变,则键角发生改变,故c正确;d、NH4+、NH3电子数都是10,故d错误;(6)本题考查晶胞的结构和晶胞的计算,①石墨中环上的碳原子被3个平面正六边形共面,因此一个环真正含有碳原子个数为6×1/3=2,C-C被2个正六边形共有,因此真正属于正六边形的C-C个数为6×1/2=3,因此六元环:C原子个数:C-C个数比为1:2:3;②碳原子位于顶点、面心、内部,个数为8×1/8+6×1/2+4=8,因此晶胞的质量为8×12/NAg,晶胞的体积为(a×10-10)cm3,根据密度的定义,ρ=96/[NA×(a×10-10)],因此
,原子总数相等,价电子总数相等的微粒互为等电子体,因此与SCN-互为等电子体的分子是N2O、CO2、CS2等;(4)本题考查影响键角的因素,①CH4没有孤电子对,属于正四面体结构,键角是10928’,②SO3没有孤电子对,属于平面三角形,键角是120 ,③H2O中心原子O有两个孤电子对,④NH3中心原子有1个孤电子对,孤电子对之间的斥力>孤电子对-成键电子对之间的斥力>成键电子对之间的斥力,因此键角的大小顺序是②>①>④>③;(5)本题考查杂化类型、键角、电子数、空间构型,a、NH3的空间构型为三角锥形,NH4+空间构型为正四面体,空间构型发生改变,故a正确;b、NH4+、NH3杂化类型都为sp3,故b错误;c、空间构型发生改变,则键角发生改变,故c正确;d、NH4+、NH3电子数都是10,故d错误;(6)本题考查晶胞的结构和晶胞的计算,①石墨中环上的碳原子被3个平面正六边形共面,因此一个环真正含有碳原子个数为6×1/3=2,C-C被2个正六边形共有,因此真正属于正六边形的C-C个数为6×1/2=3,因此六元环:C原子个数:C-C个数比为1:2:3;②碳原子位于顶点、面心、内部,个数为8×1/8+6×1/2+4=8,因此晶胞的质量为8×12/NAg,晶胞的体积为(a×10-10)cm3,根据密度的定义,ρ=96/[NA×(a×10-10)],因此![]() 。
。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】处理含铬废水的方法较多
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:

已知: Cr(OH)3―→NaCrO2―→Na2CrO4―→Na2Cr2O7
请回答:
(1)操作Ⅰ的名称为____________,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有__________。
(2)滤渣Ⅰ的主要成分为________(写化学式),试剂乙的名称为__________。
(3)加入试剂甲的目的是____________________________________________________。
(4)废水处理流程中生成滤渣Ⅲ的离子方程式为________________________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O![]() 形式存在。工业上用以下方法处理含Cr2O
形式存在。工业上用以下方法处理含Cr2O![]() 的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O
的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,还原Cr2O![]() ;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
;③经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生过滤回收沉淀,废水达到排放标准。
(5) 在②步中,电解法除铬的原理是(写出涉及的主要电极反应式和离子方程式)_____________________________________________________________。
(6)已知某含Cr2O![]() 的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
的酸性工业废水中铬元素的含量为104.5 mg·L-1,处理后铬元素最高允许排放浓度为0.5 mg·L-1。处理该废水1 000 m3并达到排放标准至少消耗铁的质量为________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能将氯化铁、氯化铵和氯化钠三种溶液区别开的一种试剂是 ( )
A. KSCN溶液 B. BaCl2溶液
C. AgNO3溶液 D. NaOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中不正确的是( )
A. 物质的量是含有一定数目粒子的集合体
B. 物质的量是国际单位制中的一个基本物理量
C. 0.012 kg12C中所含的碳原子数为NA
D. 1 mol任何物质都含有约6.02×1023个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组同学为了探究“在相同的温度和压强下、相同体积的任何气体都含有相同数目和分子”,他们设计了如下实验装置并记录相关实验数据。
实验装置:
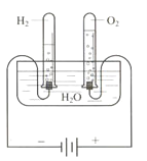
部分实验数据:
温度 | 压强 | 时间 | 水槽中H2O的质量 | H2体积 | O2体积 |
30℃ | 101 kPa | 0 | 300 g | 0 | 0 |
30℃ | 101 kPa | 4分钟 | 298.2 g | 1.243 L |
请回答下列问题:
(1)4分钟时H2、O2物质的量分别是 mol、 mol。
(2)该温度下,气体摩尔体积是 。
(3)假设电解H2O速率相同,2分钟时试管内收集到的H2的体积是 mL。
(4)根据以上实验得出如下结论,其中不正确的是 。
A. 气体摩尔体积与气体的温度相关
B. 在该实验条件下,3 mol O2的气体摩尔体积为74.58 L/mol
C. 同温、同压下,2 mol O2和2 mol CO和CO2混合气体的体积相同
D. 该实验条件下,O2的密度为1.287 g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列性质中,属于烷烃特征的是( )
A.完全燃烧产物只有二氧化碳和水
B.它们几乎不溶于水
C.分子的通式为CnH2n+2,与氯气发生取代反应
D.它们是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当反应条件(如温度、浓度或物质的量等)发生改变时,下列不会引起生成物发生改变的是
A. 钠和氧气 B. 锌和硫酸 C. 氢氧化钠和二氧化碳 D. 氢气和氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com