

分析 (1)水中c(H3O+)=c(OH-),根据K2=$\frac{c({H}_{3}O)•c({O}^{2-})}{c(O{H}^{-})}$计算氧负离子的物质的量浓度,再根据水的体积与氧负离子个数之间的关系列比例式,从而得出正确结论.
(2)催化剂的概念是反应前后催化剂的质量、化学性质均不变,据此来回答.
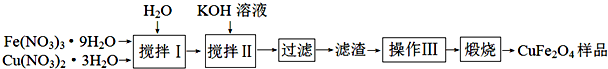
(3)①硝酸铁在水溶液中发生微弱水解生成氢氧化铁;
②依据溶度积常数计算氢氧化铁、氢氧化铜沉淀完全的溶液PH分析判断;
③流程中是过滤得到的滤渣经过洗涤干燥进行灼烧;
④氧缺位体与水反应生成氢和铁酸铜(CuFe2O4),依据原子守恒书写配平;
⑤将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,CuFe2O4-a的质量为CuFe2O4的96.6%,据此列式计算.
解答 解:(1)水中c(H3O+)=c(OH-),K2=$\frac{c({H}_{3}O)•c({O}^{2-})}{c(O{H}^{-})}$,c(O2-)=$\frac{{k}_{2}×c(O{H}^{-})}{c({H}_{3}O)}$=K2=1.0×10-36mol•L-1,
故答案为:1.0×10-36;
(2)根据题目信息可知,少量铝粉和碘反应后生成物只有碘化铝,说明水没有参加反应,但是没有加入水之前,铝粉和碘没有什么变化;加入水之后,反应放出的热量使碘升华成紫色碘蒸气,说明反应是放热反应,反应后生成物只有碘化铝白色固体,说明水改变了该反应的速率,综合分析,水是一种催化剂,
故答案为:C、D;
(3)①搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2,铁离子水解生成氢氧化铁,所以铁元素的存在形式为Fe3+和Fe(OH)3,
故答案为:Fe(OH)3;
②搅拌Ⅰ所得溶液中Fe(NO3)3、Cu(NO3)2的物质的量浓度分别为2.6mol•L-1、1.3mol•L-1,沉淀完全的离子浓度小于10-5mol/L
已知:Ksp[Fe(OH)3]=2.6×10-39,c(OH-)=$\root{3}{\frac{2.6×1{0}^{-39}}{1{0}^{-5}}}$=6.4×10-12mol/L,c(H+)=1.6×10-3mol/L,PH=3-lg1.6≈2.8,图象中铁离子沉淀完全的pH错误,Ksp[Cu(OH)2]=2.2×10-20,溶液中氢氧根离子浓度c(OH-)=$\sqrt{\frac{2.2×1{0}^{-20}}{1{0}^{-5}}}$=4.7×10-8mol/L,c(H+)=$\frac{1{0}^{-14}}{4.7×1{0}^{-8}}$=2.1×10-7mol/L,溶液的pH≈6.7,图象B符合,
故答案为:B;
③流程中是过滤得到的滤渣经过洗涤干燥进行灼烧,操作Ⅲ为洗涤、干燥,
故答案为:洗涤;干燥;
④氧缺位体与水反应制氢的化学方程式为CuFe2O4-a+aH2O=CuFe2O4+aH2↑,
故答案为:CuFe2O4-a+aH2O=CuFe2O4+aH2↑;
⑤将铁酸铜样品在N2的气氛中充分煅烧,得氧缺位体的质量为原质量的96.6%,CuFe2O4-a的质量为CuFe2O4的96.6%,则$\frac{CuF{e}_{2}{O}_{4-a}}{CuF{e}_{2}{O}_{4}}$×100%=96.6%,
解得:a=0.51,
故答案为:0.51.
点评 本题考查较为综合,涉及物质分离提纯的方法分析、溶度积常数的计算分析判断、弱电解质电离分析应用,题目难度中等,注意反应过程中原子守恒的理解应用,掌握基础是关键,试题培养了学生的分析、理解能力及灵活应用能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
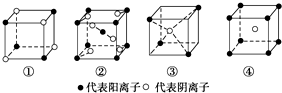
| A. | ①MR ②MR2 ③MR3 ④MR4 | B. | ①MR ②MR2 ③MR2 ④MR | ||
| C. | ①MR2 ②MR2 ③MR2 ④MR | D. | ①MR ②MR ③MR2 ④MR2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0L1.0mol•L-1的KAlO2水溶液中含有的氧原子数为2NA | |
| B. | 标准状况下,当活泼金属转移2NA个电子时,可从盐酸中置换产生44.8LH | |
| C. | 6.0g液态NaHS04中含有0.1NA个阳离子 | |
| D. | 1molH202分子中非极性共价键数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +2 | B. | +4 | C. | 0 | D. | +6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应CaC2(s)+N2(g)=CaCN2(s)+C(s)能自发进行,是因为△H<0 | |
| B. | 若电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | 向水中加入NaHCO3或NaHSO4固体后,水的电离程度均增大 | |
| D. | 对于乙酸乙酯的水解反应,加入稀硫酸会使平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2是形成酸雨的主要气体 | |
| B. | 用碱液吸收燃煤废气可减少环境污染 | |
| C. | 往燃煤中混入生石灰,可减少SO2排放 | |
| D. | 用水溶解、过滤除去煤中的单质硫以减少SO2排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 氢氧化钠溶液可以除去尾气NO2 | NO2是酸性氧化物,可与碱液反应 |
| B | 漂白粉在空气中久置变质 | 漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
| C | 用浸有酸性高锰酸钾溶液的硅土作水果保鲜剂 | 高锰酸钾能还原水果释放的催熟剂乙烯 |
| D | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl | K2CO3与NH4Cl反应会生成氨气降低肥效 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com