
NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温常压,11.2 L NO和O2混合气体的原子数为NA
B. 1.5 g甲基所含有的电子数目为0.9NA
C. 1 L 0.1mol/L的氨水中含有的N原子数小于0.1NA
D. 7.8g苯中碳碳双键的数目为0.3NA
科目:高中化学 来源:2017届山西省名校高三下学期联考理综化学试卷(解析版) 题型:简答题
2014年7月和12月山西大学分子科学研究所翟华金教授、李思殿教授与清华大学李隽教授、美国布朗大学Lai-Sheng Wang教授及复旦大学刘智攀教授课题组合作,首次合成“中国红灯笼分子”——硼球烯B40。B40是继C60之后第二个从实验和理论上完全确认的无机非金属笼状团簇。
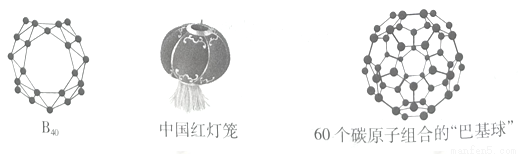
(1) 基态硼原子的外围电子排布式为___________,碳60中碳原子杂化方式为____________。
(2)构成碳60晶体的作用力是___________________。
⑶与硼同周期但第一电离能比硼大的元素有___________种。
(4)磷化硼(BP)是由硼元素与磷元素组成的无机化合物,属于一种半导体材料。磷化硼可由三溴化硼和三溴化磷在氢气中高温反应合成。BP晶胞中B采用面心立方堆积,P原子填入四面体空隙中。
①写出三溴化硼和三溴化磷的空间构型:
三溴化硼__________;三溴化磷____________。
②磷化硼晶体内微粒间的作用力有__________。
③计算磷化硼中硼原子和磷原子之间的最近距离(晶胞参数为478pm)____________ 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
有200mL氯化镁和氯化铝的混合溶液,其中c(Mg2+)为0.2mol?L-1,c(Cl-)为1.3mol?L-1。要使Mg2+全部转化为沉淀分离出来,至少需加4mol?L-1NaOH溶液的体积为
A. 40mL B. 72mL C. 80mL D. 128mL
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列说法中正确的
①17.6 g丙烷中所含的共价键数为4NA个
②常温下,21 g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
③电解饱和食盐水,当阴极产生2.24 L H2时,转移的电子数为0.2NA
④2 g D216O中含有的质子数、中子数、电子数均为NA
⑤常温下,1.0 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
⑥将100 mL0.1 mol·L-1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
A. ①②④ B. ①③⑥
C. ④⑤⑥ D. ①⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列叙述正确的是
A. 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g
B. 1 mol Na2O2固体中含离子总数为4NA
C. 1mol羟基与17 g NH3所含电子数之比为9:10
D. 一定温度下,1 L 0.5 mol·L-1NH4Cl溶液与2 L 0.25 mol·L-1NH4Cl溶液含NH的物质的量相同
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
已知一个N2O3分子的质量为a g,一个N2O5分子的质量为b g,若以一个氧原子质量的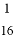 作为相对原子质量的标准,则NO2的相对分子质量为
作为相对原子质量的标准,则NO2的相对分子质量为
A. 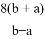 B.
B. 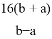 C.
C.  D.
D. 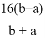
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
O2、CH4和CO的混合气体在标准状况下的密度为1.25g/L,这三种气体的物质的量之比不可能为( )
A. 3:1:2 B. 6:2:3 C. 3:4:6 D. 9:3:7
查看答案和解析>>
科目:高中化学 来源:浙江省衢州市2017届高三1月教学质量检测化学试卷 题型:简答题
氨和肼(N2H4)是氮的两种常见化合物,在科学技术和生产中有广泛应用。回答下列问题:
(1)已知:N2(g)+3H2(g)  2NH3(g) ΔH=-92.4kJ·mol-1
2NH3(g) ΔH=-92.4kJ·mol-1
在恒温、恒容的密闭容器中,合成氨反应的各物质浓度的变化曲线如图所示。
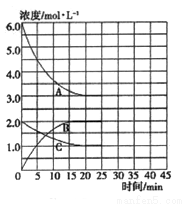
① 计算在该温度下反应2NH3(g)  N2(g)+3H2(g)的平衡常数K=________。
N2(g)+3H2(g)的平衡常数K=________。
② 在第25min末,保持其它条件不变,若将温度降低,在第35min末再次达到平衡。在平衡移动过程中N2浓度变化了0.5mol/L,请在图中画出25-40minNH3浓度变化曲线。________
③ 已知:2N2(g)+6H2O(l)  4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
4NH3(g)+3O2(g)△H=+1530.0KJ/mol则氢气的热值为_____。
(2)① N2H4是一种高能燃料具有还原性,通常用NaClO与过量NH3反应制得,请解释为什么用过量氨气反应的原因:__________
② 用NaClO与NH3 制N2H4的反应是相当复杂的,主要分为两步:
已知第一步:NH3+ClO-=OH-+NH2Cl
请写出第二步离子方程式:__________________
③ N2H4易溶于水,是与氨相类似的弱碱,己知其常温下电离常数K1=1.0×10-6,常温下,将0.2 mol/L N2H4·H2O与0.lmol/L,盐酸等体积混合(忽略体积变化)。则此时溶液的PH等于________(忽略N2H4的二级电离)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com