
| A. | 2H2 (g)+O2(g)=2H2O(l);△H=-484kJ•mol-1 | |
| B. | 2H2 (g)+O2(g)=2H2O(g);△H=+484kJ•mol-1 | |
| C. | H2 (g)+$\frac{1}{2}$O2(g)=H2O(g);△H=+242kJ•mol-1 | |
| D. | H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1 |
分析 A.是生成水蒸气,而不是液态水;
B.反应为放热反应,焓变值小于0;
C.放热反应,焓变值小于0;
D.1mol氢气燃烧生成水蒸气放出242kJ热量,则分解1mol水蒸气生成1mol氢气与$\frac{1}{2}$mol氧气吸收热量为242KJ;
解答 解:A.反应生成的是水蒸气,而不是液态水,所以热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故A错误;
B.2mol氢气燃烧生成水蒸气放出484kJ热量,焓变值为小于0,所以热化学方程式为:2H2(g)+O2(g)═2H2O(g)△H=-484kJ/mol,故B错误;
C.2mol氢气燃烧生成水蒸气放出484kJ热量,则1mol氢气燃烧生成水蒸气放出242kJ热量,所以H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ/mol,故C错误;
D..1mol氢气燃烧生成水蒸气放出242kJ热量,则分解1mol水蒸气生成1mol氢气与$\frac{1}{2}$mol氧气吸收热量为242KJ,反应热化学方程式:H2O(g)=H2(g)+$\frac{1}{2}$O2(g);△H=+242kJ•mol-1,故D正确;
故选:D.
点评 本题主要考查学生热化学方程式的书写原则,准确书写反应的化学方程式,注明反应物聚集状态,判断反应放出或者吸收热量是解题关键,该题型是现在高考的热点,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结论或目的 | |
| A | 向纯碱中滴加足量浓盐酸,将所得气体通入硅酸钠溶液中,溶液变浑浊 | 酸性:盐酸>碳酸>苯酚 |
| B | 取某溶液少量,加入盐酸酸化的氯化钡溶液,出现白色沉淀 | 该溶液中一定含有大量的SO42- |
| C | 取少量Fe(NO3)2试样加水溶液后加稀硫酸酸化,滴加KSCN溶液,溶液变为红色 | 该Fe(NO3)2试样已经变质 |
| D | 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解 | 目的:将不溶于酸的沉淀转化为易溶于酸的沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 化学键 | N≡O | Cl-Cl | Cl-N | N=O |
| 键能/kJ.mol-1 | 630 | 243 | a | 607 |
| 序号 | c(ClNO)/mol.L-1 | v/mol.L-1•s-1 |
| ① | 0.30 | 3.60×10${\;}^{-{9}^{\;}}$ |
| ② | 0.60 | 1.44×10-8 |
| ③ | 0.90 | 3.24×10-8 |
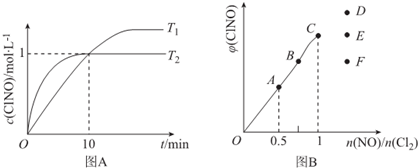
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中一定含有SO42- | |
| B. | 无色溶液中一定含有Ag+ | |
| C. | 无色溶液中一定同时含有SO42-和Ag+ | |
| D. | 无色溶液中可能含有Ag+和SO42-中的一种或两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 性质 | 实际应用 |
| A | MgO熔点高 | 可用作耐火材料 |
| B | KMnO4具有强氧化性 | 可用于漂白织物 |
| C | 常温下,铁能被浓硫酸钝化 | 常温下,可用铁质器皿盛放浓硫酸 |
| D | TiCl4在水中能发生水解 | 可用TiCl4溶液制备TiO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液氨汽化时要吸收大量的热,可用作制冷剂 | |
| B. | 次氯酸钠具有碱性,可用于配制“84”消毒液 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | SiO2既能溶于NaOH溶液又能溶于HF溶液,说明SiO2是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题:
)曾入选伦敦奥运会指定产品,下面是工业合成龙葵醛的路线图(部分反应条件及副产物已略去),回答问题: $→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛
$→_{催化剂}^{CH_{3}CH=CH_{2}}$$\stackrel{A}{{C}_{9}{H}_{12}}$$→_{光照}^{Cl_{2}}$$\stackrel{B}{{C}_{9}{H}_{11}{C}_{1}}$→${\stackrel{C}{{C}_{9}{H}_{10}}}_{\;}$$\stackrel{HBr}{→}$$\stackrel{D}{{C}_{9}{H}_{11}Br}$→$\stackrel{E}{{C}_{9}{H}_{12}O}$$→_{△}^{催化剂}$龙葵醛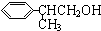 +O2
+O2
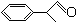 +2H2O.
+2H2O. 或
或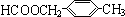 (任写一种).
(任写一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com