
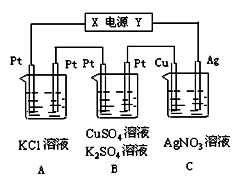
| A.若使电解质溶液恢复到电解前的浓度可向溶液中加入9.8×(10-b-10-a)g Cu(OH)2 |
| B.b<a<7 |
| C.阳极产生的气体是O2,其体积(标准状况下)为:1.12×(10-b-10-a)L |
| D.阴极电极反应式为:Cu2++2e-=Cu |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CuSO4 | B.MgSO4 | C.Al (NO3)3 | D.Na2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为除去污水中的重金属离子Hg2+,向其中加入足量充分反应后过滤 |
| B.为降低能耗,工业电解熔融态的Al2O3制Al时,加入冰晶石 |
| C.为充分利用原料,氯碱工业中,将阳极室的饱和氯化钠溶液电解为水后导出 |
| D.为保护公路两旁的铁护栏,将其与电源的负极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
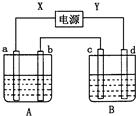
| 选项 | 电源X极 | 实验前U形管中液体 | 通电后现象及结论 | |
| A | 正极 | Na2SO4溶液 | U形管两端滴入酚酞试液后,a管中呈红色 | |
| B | 正极 | AgNO3溶液 | b管中电极反应式是:4OH--4e-===2H2O+O2↑ | |
| C | 负极 | KCl和CuCl2混合溶液 | 相同条件下,a、b两管中产生的气体总体积可能相等 | |
| D | 负极 | Fe(OH)3胶体和导电液 | b管中液体颜色加深 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ”。
”。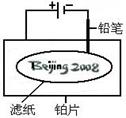
| A.铅笔作阴极:电极反应为:2H+ + 2e- = H2↑ |
| B.铂片作阳极:电极反应为:2Cl-- 2e- = Cl2↑ |
| C.铅笔与滤纸接触处有少量Cl2逸出 |
D.上述反应总的离子方程式可表示为2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
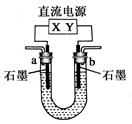
| A.0.1mol | B.0.2mol | C.0.3mol | D.0.4mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3CH2OH + CH3COOH
CH3CH2OH + CH3COOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com