
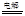 2OH?+H2ӟ+Cl2ӟ
2OH?+H2”ü+Cl2”ü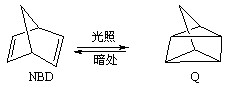 £¬ĄūÓĆøĆ·“Ó¦æÉŅŌÖü“ęĢ«ŃōÄÜ£¬ŌņNBDµÄÄŚÄܱČQµÄÄŚÄÜøß
£¬ĄūÓĆøĆ·“Ó¦æÉŅŌÖü“ęĢ«ŃōÄÜ£¬ŌņNBDµÄÄŚÄܱČQµÄÄŚÄÜøß| »Æѧ¼ü | N”ŌN | H?O | N?H | O=O |
| ¼üÄÜ/kJ”¤mol-1 | 945 | 463 | 391 | 498 |
 2NH3(g)+ 3/2O2(g)£»”÷H=+630kJ”¤mol-1
2NH3(g)+ 3/2O2(g)£»”÷H=+630kJ”¤mol-1
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
| »ÆѧŹ½ | HF | H2CO3 | HClO |
| µēĄėĘ½ŗā³£Źż £ØK£© | 7.2”Į10-4 | K1=4.4”Į10-7 K2=4.7”Į10-11 | 3.0”Į10-8 |
 SO2Cl2(l) ”÷H£½ØC97.3kJ”¤mol”Ŗ1
SO2Cl2(l) ”÷H£½ØC97.3kJ”¤mol”Ŗ1²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
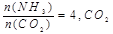 µÄ×Ŗ»ÆĀŹĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼1ĖłŹ¾”£
µÄ×Ŗ»ÆĀŹĖꏱ¼äµÄ±ä»Æ¹ŲĻµČēĶ¼1ĖłŹ¾”£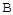 µćĖŁĀŹĪŖVÕż£ØCO2£©£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©
µćĖŁĀŹĪŖVÕż£ØCO2£©£ØĢī”°“óÓŚ”±”¢”°Š”ÓŚ”±»ņ”°µČÓŚ”±£©
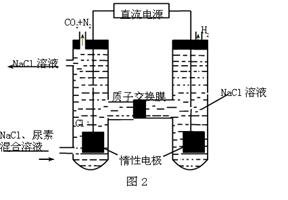
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
 CH3OH(g) ¦¤H1
CH3OH(g) ¦¤H1 CH3OH(g) + H2O(g) ¦¤H2
CH3OH(g) + H2O(g) ¦¤H2| ĪĀ¶Č | 250”ę | 300”ę | 350”ę |
| K | 2.041 | 0.270 | 0.012 |
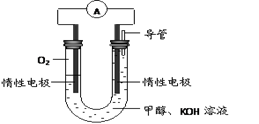
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
A£®·“Ó¦A£Øg£© 2B£Øg£©£»”÷H£¬ČōÕż·“Ó¦µÄ»ī»ÆÄÜĪŖEa kJ mol-1£¬Äę·“Ó¦µÄ»ī»ÆÄÜĪŖEb kJ”¤mol-1£¬Ōņ”÷H=£ØEa£Eb£©kJ”¤mol-1 2B£Øg£©£»”÷H£¬ČōÕż·“Ó¦µÄ»ī»ÆÄÜĪŖEa kJ mol-1£¬Äę·“Ó¦µÄ»ī»ÆÄÜĪŖEb kJ”¤mol-1£¬Ōņ”÷H=£ØEa£Eb£©kJ”¤mol-1 |
| B£®ŅŃÖŖ25”ꏱ£¬ÓŠ¹ŲČõĖįµÄµēĄėĘ½ŗā³£Źż£ŗHCN Ka=4.9”Į10-10£» H2CO3 Ka1=4.3”Į10-7£¬Ka2=5.6”Į10-11”£ŌņCO2ĶØČėNaCNČÜŅŗÖŠ·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2NaCN+H2O+CO2=2HCN+Na2CO3 |
C£®ŅŃÖŖ£ŗ Ōņ·“Ó¦  µÄģŹ±äĪŖ¦¤H = £384 kJ”¤mol-1 µÄģŹ±äĪŖ¦¤H = £384 kJ”¤mol-1 |
| D£®Ņ»¶ØÅØ¶ČµÄNaOHČÜŅŗ£¬ĪĀ¶ČÉżøßPHÖµ²»±ä |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
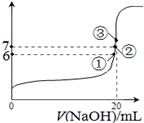
 2NH3 ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ
2NH3 ŌŚŗćČŻĆܱÕČŻĘ÷ÖŠ½ųŠŠ£¬“ļµ½Ę½ŗāדĢ¬µÄ±źÖ¾ŹĒ | Ź±¼ä/min | 5 | 10 | 15 | 20 | 25 | 30 |
| C(NH3)/mol”¤L-1 | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗĢīæÕĢā
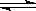 2NH3(g)+ O2(g)”£»Ų“šĻĀĮŠĪŹĢā£ŗ
2NH3(g)+ O2(g)”£»Ų“šĻĀĮŠĪŹĢā£ŗ| T/K | 303 | 313 | 323 |
| NH3Éś³ÉĮæ/£Ø10-6 mol£© | 4.8 | 5.9 | 6.0 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ²»Ļź ĢāŠĶ£ŗµ„Ń”Ģā
| A£®ÖŹĮæŹŲŗć¶ØĀÉ | B£®ŌŖĖŲÖÜĘŚĀÉ |
| C£®ĻąĖĘĻąČÜŌĄķ | D£®ÄÜĮæ×īµĶŌĄķ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com