
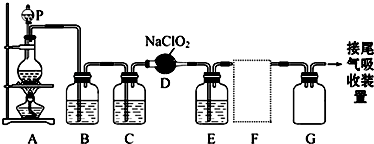

分析 由题目中所给信息和实验装置图可知:本实验首先用浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2++Cl2↑+2H2O,经除杂、干燥后在D中亚氯酸钠固体反应生成ClO2,由于Cl2易溶于CCl4液体,E用于除去ClO2中的未反应的Cl2,最后用向上排空法收集;并注意气体的性质和装置来分析防止倒吸的装置,利用稀盐酸与二氧化锰不反应来分析浓盐酸与足量的MnO2制备Cl2,被氧化的HCl的物质的量.
解答 解:(1)实验室用浓盐酸和MnO2在加热条件下反应制备Cl2,浓盐酸应盛装在分液漏斗中,则P为分液漏斗,
故答案为:分液漏斗;
(2)浓盐酸和MnO2在加热条件下反应制备Cl2,反应的方程式为MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(3)生成的氯气中混有HCl和水,为制备纯净干燥的氯气,根据氯气不溶于饱和食盐水的性质,可用饱和食盐水除去气体中混有的HCl杂质,然后用浓硫酸干燥除去水,
故答案为:饱和食盐水;除去氯气中的氯化氢气体;
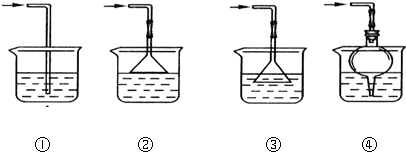
(4)ClO2是一种易溶于水的气体,且密度比空气大,应用向上排空气法收集,且进行尾气处理,故用双孔橡皮塞;
故答案为:②;d;
(5)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,②④符合;
故答案为:D.
点评 本题考查气体的制备、除杂、收集等实验操作,题目难度不大,学习中注意把握化学实验基本操作,做该类题目时把握实验目的和实验原理是解答题目的关键.


 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-4b kJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$O2(g) 2CO2(g)+H2O(l);△H=2b kJ/mol | |
| C. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=-2b kJ/mol | |
| D. | 2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H=b kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
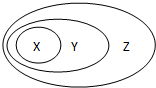 用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )
用如图表示的一些物质或概念之间的从属或包含关系中,错误的是( )| X | Y | Z | |
| A | 盐酸 | 分散系 | 混合物 |
| B | 铜 | 金属元素 | 元素 |
| C | 氧化铝 | 电解质 | 化合物 |
| D | KHSO4 | 酸 | 无机物 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤是由有机物和无机物组成的复杂混合物 | |
| B. | 煤的干馏是工业上获得芳香烃的一种重要来源 | |
| C. | 煤在空气中加强热的过程叫做煤的干馏 | |
| D. | 煤焦油中含有苯和甲苯,可以用分馏的方法把它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠存放于煤油中 | |
| B. | 硝酸贮存在避光低温处 | |
| C. | 在盛溴的试剂瓶中加一定量的水液封,防止溴的挥发 | |
| D. | 单质碘贮存在棕色的细口瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
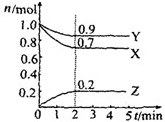 某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:
某温度时在2L容器中X、Y、Z三种气体物质的物质的量(n)随时间(t)变化的曲线如右图所示,由图中数据分析:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:1 | C. | 9:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用毛巾蘸取肥皂水捂嘴防毒 | B. | 在氯气泄露的地区人应站在高处 | ||
| C. | 向氯气喷洒稀氨水可以消毒 | D. | 将泄露的氯气在空气中点燃除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com