
【题目】室温下,用相同物质的量浓度的HC1溶液,分别滴定物质的量浓度均为0.1mol·L-1。的三种碱(AOH、BOH和DOH)溶液,滴定的曲线如图所示,下列判断正确的是
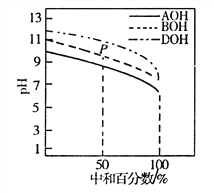
A. 滴定时,随着盐酸溶液的滴入,水电离出的c(H+)始终增大
B. 滴定至P点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,三种溶液中c(C1-)相等
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-)
【答案】D
【解析】A、酸溶液和碱溶液都抑制水的电离,盐类水解促进水的电离,随着盐酸溶液的滴入,溶液由碱溶液变为盐溶液再变为酸溶液,水电离出的c(H+)先增大后减小,错误;B、滴定至P点时溶质为等物质的最的BOH和BCl,溶液呈碱性,BOH的电离为主,但电离程度较小,因此c(B+)>c(Cl-)>c(BOH)>c(OH-)>c(H+),错误;C、pH=7时,三种溶液中阳离子的水解程度不同,加入的盐酸的体积不同,三种离子浓度分别与氯离子浓度相等,但三种溶液中氯离子浓度不等,错误;D、当中和百分数达100%时,将三种溶液混合后的质子守恒为:c(AOH)+c(BOH)+c(DOH)=c(H+)-c(OH-),正确。答案选D。


科目:高中化学 来源: 题型:
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )

A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应2SO2 + O2 ![]() 2SO3 ,反应达平衡的标志是( )
2SO3 ,反应达平衡的标志是( )
①单位时间内消耗2 mol SO2 的同时生成2 mol SO3
②反应混合物中,SO2、O2 与SO3 的物质的量之比为2∶1∶2
③反应混合物中,SO3的质量分数不再改变
A. ①② B. ①③ C. 只有③ D. 只有①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是一种新型香料的主要成分之一,其结构中含有三个六元环。G的合成路线如下(部分产物和部分反应条件略去):
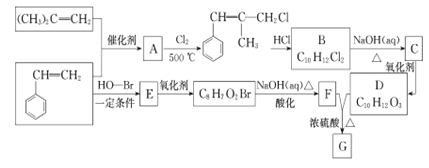
己知:① RCH=CH2+CH2=CHR----CH2=CH2+RCH=CHR;
② B的核磁共振氢谱图显示分子中有6 种不同环境的氢原子;
③D和F互为同系物。
(1)(CH3)2C=CH2,分子中在同一平面内的原子数最多为_____。D分子中含有的含氧官能团名称是________。
(2)A→B反应过程中涉及的反应类型依次为______、_______。
(3)E的结构简式为_______。G的结构简式为________。
(4)B→C的化学方程式为___________________。
(5)写出同时满足下列条件的F的一种同分异构体的结构简式__________。
①能与FeCl3溶液发生显色反应;② 苯环上有两个取代基且能发生水解反应;
③其核磁共振氢谱图中有4 组峰。
(6)模仿由苯乙烯合成F的方法,写出由丙烯制取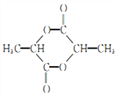 的合成路线:_______。
的合成路线:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式或离子方程式中,正确的是:
A.甲烷的标准燃烧热为890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3 kJ/mol
B.CO(g)的燃烧热是283.0 kJ/mol ,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+2×283.0 kJ/mol
C.NaOH和HCl反应的中和热 △H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-38.6kJ/mol
2NH3(g) △H=-38.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在碱性溶液中可发生如下反应:2R(OH)3 + 3C1O- + 4OH- = 2RO4n- + 3Cl- + 5H2O则RO4n-中r的化合价是( )
A.+3 B.+4 C.+5 D.+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法” 。完成下列填空:
(l)l0Be和9Be_______。
a.是同一种原子 b.具有相同的中子数
d.具有相同的化学性质 d.互为同位素
⑵写出A1与NaOH溶液反应的化学方程式:___________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是__________。
a.比较Mg (OH) 2与A1 (OH) 3的碱性强弱
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的单质的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的常见阴离子的半径由大到小的顺序:_______(用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠是一种重要的化工原料。泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
(1)NaCN的电子式为_______。
(2)NaCN与双氧水反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,用H2O2处理1molNaCN时,反应中转移电子的物质的量为______mol。
(3)NaCN也能被酸性高锰酸钾溶液氧化,产生对大气无污染的气体和Mn2+,该反应的离子方程式是____________。
(4)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
I.实验室通过下图装置制备Na2S2O3。
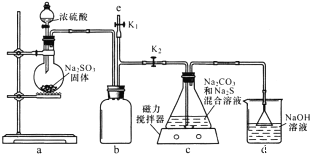
①装置中盛浓硫酸的仪器是_____,b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有____________。
③实验结束后,在e处最好连接盛NaOH溶液的容器,再________________(填具体操作),最防止拆除装置时污染空气。
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取15.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_______________。
(7)经计算处理后的废水中NaCN的浓度为________mg/L(保留两位小数),处理后的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com