
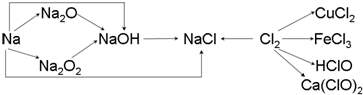
分析 (1)Na的密度比水的密度小,比煤油密度大,在煤油中可隔绝空气与水,钠与水反应生成NaOH和氢气;
(2)过氧化钠为淡黄色固体,与二氧化碳反应生成氧气,可作供氧剂;
(3)氯气与NaOH反应生成氯化钠、次氯酸钠和水,用于氯气的尾气处理;
(4)氯水中含氯离子,与硝酸银反应生成白色沉淀;
(5)用氯气和石灰乳反应制漂白粉,有效成分为次氯酸钙,在空气中会失效,是因先与水、二氧化碳反应生成HClO,后HClO分解而失效.
解答 解:(1)金属钠的密度比水小,实验室中金属钠通常保存在煤油中,一小块金属钠投入水中的反应方程式是2Na+2H2O=2NaOH+H2↑,
故答案为:小;煤油;2Na+2H2O=2NaOH+H2↑;
(2)Na2O2是淡黄色的固体,Na2O2的重要用途是做呼吸面具的供氧剂,有关反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,
故答案为:淡黄;做呼吸面具的供氧剂;2Na2O2+2CO2=2Na2CO3+O2;
(3)多余的氯气应用NaOH溶液吸收,其化学方程式为Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(4)新制的氯水滴入AgNO3溶液中,观察到生成白色沉淀,原因是氯水中有Cl-,故答案为:生成白色沉淀;氯水中有Cl-;
(5)工业上用氯气和石灰乳反应制漂白粉,漂白粉的有效成分是Ca(ClO)2,漂白粉长时期露至在空气中会失效,用化学方程式表示其失效的原因:Ca(ClO)2+H2O+CO2=CaCO3+2HClO、2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑,
故答案为:Ca(ClO)2;Ca(ClO)2+H2O+CO2=CaCO3+2HClO;2HClO$\frac{\underline{\;光照\;}}{\;}$2HCl+O2↑.
点评 本题考查综合元素化合物知识,为高频考点,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,注重基础知识的夯实,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
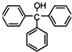 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示.
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示. ;
;
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、笨等有机溶剂 |
| 溴苯 | -30.7℃ | 156.2℃ | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸已酯 | -34.6℃ | 212.6℃ | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 1将一小块金属钠放入滴有酚酞溶液的冷水中 2将一小段用砂纸打磨后的镁带,放入试管中,加入少量水,加热至水沸腾,再向试管中滴加酚酞溶液 3将一小段镁带投入稀盐酸中 4将一小片铝投入稀盐酸中. |
| 实验现象 | A剧烈反应,迅速生成大量的气体 B浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红 C反应不剧烈,产生无色气体 D有气体产生,溶液变成红色 |
| 实验步骤 | 1 | 2 | 3 | 4 |
| 实验现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①② | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com