
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
|
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 |
|
| B. | 氢氧化铜可溶于氨水说明氢氧化铜是两性氢氧化物 |
|
| C. | 在[Cu(NH3)4]2+离子中,Cu2+提供空轨道,NH3给出孤电子对 |
|
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤电子对,NH3提供空轨道 |
考点:
配合物的成键情况.
专题:
化学键与晶体结构.
分析:
A.硫酸铜先和氨水反应生成氢氧化铜,氢氧化铜和氨水反应生成络合物;
B.两性氢氧化物是指既能溶于强酸又能溶于强碱的氢氧货物,而氢氧化铜不能溶于强碱;
C.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键;
D.配合物中,配位体提供孤电子对,中心原子提供空轨道形成配位键.
解答:
解:A.铜离子先和氨水反应生成蓝色的氢氧化铜沉淀,氢氧化铜再和氨水反应生成铜氨络合物,所以反应后溶液中铜离子浓度减小,故A错误;
B.两性氢氧化物是指既能溶于强酸又能溶于强碱的氢氧货物,而氢氧化铜不能溶于强碱,故B错误;
C.在[Cu(NH3)4]2+离子中,铜离子含有空轨道,氨气分子含有孤电子对,所以Cu2+提供空轨道,NH3给出孤电子对,故C正确;
D.根据C知,Cu2+提供空轨道,NH3给出孤电子对,故D错误;
故选C.
点评:
本题考查了配合物的成键情况,明确配位键的形成条件是解本题关键,注意配位键属于共价键,为易错点.


科目:高中化学 来源: 题型:
广口瓶是中学实验中常用仪器之一,下列各装置中均有广口瓶,请填空:
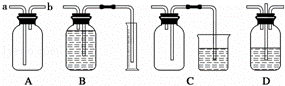
(1)装置A可用于收集气体,如H2,若装置A是干燥的,则气体应从 口进入(填“a”或“b”,下同),若A中充满水,则气体应从 口进入.
(2)装置B通常用于 ,注意事项是 .(写出两条)
(3)装置C的用途是 .
(4)装置D中长导管的作用是 ) .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数,下列说法中正确的是( )
|
| A. | 7.8g过氧化钠固体中含阴离子个数为0.2NA |
|
| B. | 34g氨气中含N﹣H的数目为6NA |
|
| C. | 标准状况下,22.4L乙炔中含π键数为2NA |
|
| D. | 1molNaHSO4晶体中阳离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)按要求填空:周期表中电负性最大的元素的基态原子核外电子排布式 ;第三周期元素中离子半径最小的元素的价电子排布式 ; Cu2+的电子排布式: .
(2)在下列物质中:①N2、②H2S、③KOH、④MgCl2、⑤C2H4、⑥Na2O2、⑦NH4C1⑧苯(C6H6)(用序号填空)其中只含有非极性键的是 ;只含有离子键的是 ;既含有非极性键又含有极性键的是 ;含有非极性键的离子化合物是 ,上述物质存在范德华力的是 .
(3)短周期元素中,X原子核外L层中只有两对成对电子,Y原子价电子排布为nsnnpn,Z原子最外层电子数比内层电子总数少4,则YX2与 ZX2分子的空间构型依次为 、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
)实验室制取H2的反应方程式为:Zn+H2SO4═ZnSO4+H2↑.
(1) 是氧化剂; 是还原剂; 元素被氧化; 元素被还原; 是氧化产物; 是还原产物.
(2)用双线桥表示出该反应电子转移的方向和数目 :Zn+H2SO4═ZnSO4+H2.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,不是按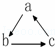 (“→”表示一步完成)关系相互转化的是( )
(“→”表示一步完成)关系相互转化的是( )
| 选项 | A | B | C | D |
| a | Fe | H2SO4 | Al(OH)3 | HNO3 |
| b | FeCl3 | SO2 | Na[Al(OH)4] | NO |
| c | FeCl2 | SO3 | Al2O3 | NO2 |
|
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com